Reports
Une percée technologique dans la lutte contre la grippe saisonnière protégera le monde contre la prochaine pandémie
This report is based on medical evidence presented at sanctioned medical congress, from peer reviewed literature or opinion provided by a qualified healthcare practitioner. The consumption of the information contained within this report is intended for qualified Canadian healthcare practitioners only.
FRONTIERES MEDICALES - Options X for the Control of Influenza (ISIRV 2019)
Singapour / 28 août-1er septembre 2019
Singapour – Selon la Stratégie mondiale de lutte contre la grippe 2019-2030 de l’Organisation mondiale de la Santé (OMS), la prochaine pandémie de grippe est une certitude ; seul le moment est imprévisible. Malgré 70 années de recherche et de progrès, d’importants obstacles à la prévention de cette menace mondiale demeurent. Les solutions possibles font fi de nombreuses frontières. Options X for the Control of Influenza, le plus vaste congrès mondial sur la grippe, permet une collaboration interdisciplinaire unique mettant à profit l’interdépendance de la recherche sur la grippe saisonnière et de la recherche sur la pandémie. Grâce aux avancées de la lutte contre la grippe saisonnière, nous pouvons bien nous préparer à une pandémie, au dire de nombreux conférenciers. Le congrès a surtout porté sur les vaccins ainsi que sur l’urgence d’améliorer leur efficacité, d’accélérer leur production et d’élargir leur couverture et l’éventail d’options pour les personnes vulnérables. Une cinquantaine de communications et d’affiches ont porté sur la performance des vaccins non produits sur œuf et fourni de nouvelles données cliniques rassurantes, notamment sur les vaccins à forte dose ou avec adjuvant.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
« Pour la quasi-totalité de la planète, le vaccin contre la grippe saisonnière n’est pas un problème majeur [...]; seule la pandémie est inquiétante », affirmait le Dr Martin Friede de l’OMS dans son allocution. « Se prémunir contre une pandémie sans être bien préparés pour la grippe saisonnière est presque impossible. » La préparation à une pandémie passe par l’amélioration des vaccins actuels, selon la Stratégie mondiale de lutte contre la grippe 2019-30 de l’OMS, qui souligne la nécessité d’améliorer, d’élargir et de prolonger la protection vaccinale et d’accélérer la production. « Pourquoi [une efficacité] de seulement 50 %, pourquoi une protection si brève ? », poursuit-il.
La Pre Kanta Subbarao, directrice, Peter Doherty Institute for Infection and Immunity, Australie, a aussi parlé de la fausse dichotomie entre la lutte contre la grippe saisonnière et la lutte contre la grippe pandémique. « Une grave épidémie peut avoir autant d’impact qu’une pandémie », affirme-t-elle, citant la saison grippale 2017-18 qui a causé presque autant de cas que la pandémie [H1N1] de 2009. »
Le Dr Dan Jernigan, Centers for Disease Control (CDC) aux É.-U., a encouragé les fabricants à continuer d’investir dans les nouvelles techniques de production des vaccins. Aux É.-U., une augmentation de 5 % de l’efficacité vaccinale peut prévenir 1 million de cas et 25 000 hospitalisations (Figure 1). « Une augmentation plutôt faible pourrait donc prévenir un grand nombre de cas », enchaîne-t-il.
Les avancées de la technologie vaccinale ont été au cœur du congrès. Plus de 40 communications et affiches concernaient
Figure 1.
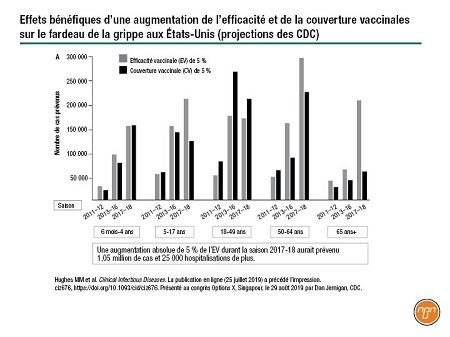
l’augmentation de l’efficacité vaccinale dans les populations vulnérables grâce à d’autres méthodes que la production sur œuf (vaccins cellulaires et recombinants) et à l’utilisation d’adjuvants et de préparations à forte dose. Plusieurs équipes de chercheurs ont présenté des approches novatrices pour améliorer la couverture vaccinale.
Vaccins non produits sur œuf
« L’œuf nous a très bien servis, mais il est temps de passer à un autre moyen sûr et efficace », affirme la Dre Catherine Moore, scientifique clinicienne conseil, Public Health Wales, Royaume-Uni (voir p. 4).
Le premier vaccin produit sur culture cellulaire, homologué par la FDA aux É.-U. en 2017, ciblait la souche H3N2. En 2019, des vaccins produits sur culture cellulaire ciblant les 4 souches sont homologués dans plusieurs pays. Pas étonnant, donc, que la comparaison des vaccins produits sur culture cellulaire et sur œuf ait fait l’objet de vifs débats au congrès.
Une affiche a porté sur les réponses sérologiques à la souche H3N2 A/Hong Kong/4801/2014 (HK 14) chez 244 enfants de Gambie vaccinés. Le Dr Ruthiran Kugathasan, Imperial College, Londres, U.-K., et coll. ont constaté que la réponse IgA dans la muqueuse nasale au virus cultivé sur cellules était égale ou supérieure à la réponse au virus HK14 répliqué sur œuf. « Il nous faut d’autres données sur l’efficacité de la souche A (H3N2) chez de jeunes enfants recevant un vaccin antigrippal à virus vivant atténué vu les réponses anticorps observées dans le sérum et les muqueuses », concluent les auteurs.
Une équipe de Seqirus dirigée par le Dr Sankarasubramanian Rajaram a actualisé une analyse rétrospective des données publiques du Worldwide Influenza Centre, Londres, pour les saisons grippales 2013-18. Le groupe avait déjà publié des données montrant que la souche H3N2 circulante était, sur le plan antigénique, plus semblable aux virus de référence cultivés sur cellules qu’aux virus produits sur œuf. L’affiche portait sur les lignées B/Victoria (BVic) et B/Yamagata (BYam). Comme les souches BVic ressemblent étroitement aux souches H3N2, la souche BVic circulante était, sur le plan antigénique, plus semblable aux souches cultivées sur cellules qu’aux souches produites sur œuf. La ressemblance était moindre pour la souche BYam.
Plusieurs affiches abordaient l’impact réel des vaccins produits sur culture cellulaire. Van Hung Nguyen, VHN Consulting inc., a collaboré avec des cliniciens du R.-U. et d’Espagne pour comparer l’efficience du vaccin antigrippal quadrivalent cultivé sur cellules (QIVc) à celle du vaccin produit sur œuf (QIVe) durant la saison 2017-18. Les vaccins cultivés sur cellules étaient plus efficients et ont allégé le fardeau de la maladie dans les deux pays. Chez les adultes du R.-U., par exemple, le QIVc « peut éviter en moyenne 158 300 cas de grippe symptomatique, 18 300 visites en ambulatoire, 410 hospitalisations et 66 décès ». Au Canada, Van Hung Nguyen et coll. ont effectué une modélisation de l’efficacité vaccinale à partir des données des saisons 2011–18. Ils ont prédit que le QIVc serait 18 %, 26 % et 10 % plus efficace que le QIVe chez les enfants, les adultes et les plus de 65 ans au Canada. Les deux études étaient financées par Seqirus.
Les présentations sur les vaccins recombinants contre la grippe saisonnière ont porté en grande partie sur la réponse immunitaire. Par exemple, Novavax (É.-U.) a présenté les résultats de sept préparations expérimentales de son vaccin quadrivalent recombinant à base de nanoparticules d’hémagglutinines du virus de la grippe saisonnière (NIVq) avec adjuvant (saponines ; Matrix-M1) . À 28 jours, les titres d’anticorps inhibant l’hémagglutination (AIH) étaient 17 à 48 % plus élevés avec trois des vaccins recombinants de Novavax qu’avec Fluzone.
Vitesse de fabrication
La production sur culture cellulaire est plus rapide, surtout en contexte de pandémie, affirme la Pre Subbarao. La production sur œuf est « un réel casse-tête logistique », dit-elle, rappelant à l’auditoire que 95 % des vaccins homologués sont produits sur œuf.
Le Pr Steven Riley, Imperial College, Londres, et coll. ont présenté une affiche expliquant que « grâce à la technologie et à la capacité de production actuelles, on peut produire 400 millions de doses après un délai de 180 jours ». Ayant modélisé une pandémie grippale modérément sévère, ces chercheurs ont calculé qu’environ 400 000 décès pourraient être évités si le délai de production était ramené de 180 à 90 jours, et plus de 600 000 décès si la production pouvait commencer dans les 7 jours.
Durant le congrès, plusieurs chercheurs ont fait état de nouvelles données sur l’accélération de la production des vaccins liée à la culture cellulaire. Une affiche de Seqirus a familiarisé les congressistes avec son système de production à grande échelle et à haute capacité à base de cellules rénales canines Madine-Darby (MDCK) et avec les « tableaux de leaders » sur le plan du rendement en HA pour chacun des virus grippaux principaux. À ce jour, les souches B ont été celles qui ont donné les meilleurs rendements; suivaient les souches H3N2 et H1N1 (rendement le plus faible). Le Dre Tsai-Chuang Weng, National Institute of Infectious Diseases and Vaccinology, Taïwan, a présenté une affiche montrant une productivité accrue de vaccins produits sur cellules MDCK en suspension. L’équipe de Taïwan se concentre maintenant sur la variabilité d’échelle de la technologie, car les titres maximums de HA de la souche H7N9 ont chuté lorsque le processus est passé d’un bioréacteur de 5L à un de 50L.
Vaccins antigrippaux
pour les populations vulnérables
Le fardeau grippal pèse sur les adultes âgés de manière disproportionnée, estime la Dre Melissa Andrew, professeure agrégée de gériatrie, Dalhousie University, Canada, qui présentait les résultats du réseau SOS (Serious Outcomes Surveillance) du Canada. « Le véritable objectif du réseau est de mesurer le succès du vaccin chez les adultes âgés », poursuit-elle. Pendant la saison 2017-18 au Canada, 76 % des hospitalisations pour cause de grippe sont survenues chez les plus de 65 ans; cependant, la diminution de l’efficacité du vaccin est proportionnelle à la fragilité et non à l’âge avancé. De nombreux adultes âgés hospitalisés pour cause de grippe présentent un déclin fonctionnel très marqué, et 5 % ne s’en remettent jamais. Plusieurs pays, dont le Canada et l’Australie, fabriquent des vaccins antigrippaux trivalents à forte dose ou avec adjuvant (TIVa) pour les adultes âgés. Ces vaccins ont figuré dans 30 affiches et communications, et ont suscité beaucoup d’intérêt.
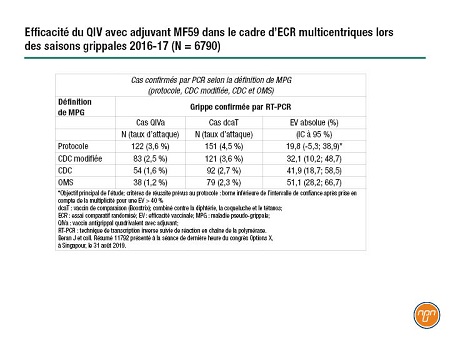
Par exemple, on a présenté au congrès les résultats de dernière heure d’une vaste étude multicentrique prospective sur l’efficacité d’un vaccin quadrivalent expérimental contenant l’adjuvant MF59 (QIVa) qui a été menée dans 12 pays lors de deux saisons grippales consécutives – 2016-2017 dans l’hémisphère Nord et 2017 dans l’hémisphère Sud. Regroupant 6790 adultes de plus de 65 ans, l’étude comparait le QIVa de Seqirus à un vaccin non antigrippal (Boostrix) quant aux cas de grippe confirmée par PCR. Les cas étaient repérés selon différentes définitions d’une maladie pseudo-grippale [MPG]). Selon la définition de MPG prévue au protocole, le vaccin a été efficace à environ 20 %, ce qui est non significatif. Cependant, lorsqu’une fièvre plus élevée était prise en compte (définitions des CDC et de l’OMS), l’efficacité passait à 51 %, ce qui est statistiquement significatif (Tableau 1). Ce taux d’efficacité a été obtenu malgré le mésappariement à 93 % des souches circulante et vaccinale de H3N2 durant cette saison, précise le Dr Jonathan Edelman.
Tableau 1.
Deux analyses rétrospectives de demandes de règlement aux É.-U. ont comparé directement Fluzone à forte dose [HD], Fluad [TIVa] et un QIV. La première – de Sanofi Pasteur – a fait ressortir une réduction de 12 % de toutes les hospitalisations pour cause respiratoire en faveur de HD (vs TIVa) et a généré un vif débat sur la méthodologie après la présentation. Les études de la deuxième série – de Seqirus – ont été menées selon les méthodes récentes des CDC pour l’évaluation de l’efficacité des vaccins antigrippaux dans les bases de données de demandes de règlement aux É.-U. Dans ces analyses, le TIVa a été plus efficace que le QIV et HD pour diminuer le nombre de visites chez le médecin pour cause de grippe (36,3 % et 16,6 %). Sur le plan des hospitalisations et des visites aux urgences liées à la grippe, le TIVa a été 8,6 % plus efficace que le QIV et aussi efficace que HD. Sur le plan des hospitalisations liées à une cause respiratoire ou cardiovasculaire, le TIVa a prévenu plus efficacement d’autres visites pour causes respiratoires à l’hôpital comparativement au QIV (4,0 %) et au HD (2,4 %). Il n’y avait aucune différence statistique entre le TIVa et le HD quant à la réduction d’autres événements cardiorespiratoires graves ou du nombre d’hospitalisations toutes causes confondues.
Seqirus a présenté par affiche les résultats d’un ECR de phase 3 à double insu qui comparait le QIVa expérimental avec son TIVa homologué aux É.-U. Regroupant 1778 patients de plus de 65 ans, l’étude a révélé que l’ajout d’une deuxième souche B ne nuisait pas à la réponse immunitaire vis-à-vis des autres souches.
Dans d’autres affiches, on a comparé des vaccins avec ou sans adjuvant quant à l’immunogénicité. Athena Pui Yee Li et coll., University of Hong Kong, ont comparé le vaccin à virus inactivé et à dose standard (IIV), le vaccin avec adjuvant MF59, le vaccin à forte dose d’HA et le vaccin à base de HA recombinante chez des adultes de Hong Kong. L’équipe a constaté que malgré la similitude des quatre vaccins quant aux titres d’AIH, les anticorps associés au vaccin avec adjuvant se liaient avec plus d’avidité, et les titres d’anticorps très avides étaient plus élevés. « Les titres ne sont pas forcément différents, mais les anticorps associés au vaccin avec adjuvant sont de meilleure qualité et se lient à l’antigène avec plus de force », explique l’auteure. L’équipe a aussi constaté que les taux de lymphocytes T auxiliaires folliculaires étaient bien corrélés avec les réponses humorales aux vaccins avec adjuvant et aux vaccins à forte dose, mais pas aux vaccins à dose standard. « Il semble donc que les vaccins à forte dose et les vaccins avec adjuvant viennent à bout de l’immunosénescence », conclut-elle.
Le Pr Robert Booy, Australia’s National Centre for Immunisation Research and Surveillance (NCIRS), a rappelé à l’auditoire d’un symposium financé par GSK que les enfants sont aussi vulnérables durant la saison grippale. Contrairement à d’autres infections, la moitié de tous les cas chez les moins de 5 ans touchent des enfants en santé, et une hospitalisation sur huit se solde par la mort. Durant ce symposium, la Dre Halima Tahrat a présenté les résultats de l’essai de phase 3 sur un vaccin quadrivalent à virus inactivé de GSK (D-QIV) chez 12 018 enfants de 6 à 35 mois (premiers résultats présentés l’année dernière). Le vaccin a été efficace à 50 % toutes sévérités confondues et à 63 % contre les cas de grippe modérée à sévère.
Seqirus a présenté les résultats actualisés de l’essai pivot sur son QIVa vs Fluzone chez des enfants. Aux fins d’évaluation de l’efficacité de la revaccination par le QIVa, 1208 enfants de l’étude initiale ont été revaccinés l’année suivante. « En conclusion, oui, le vaccin avec adjuvant MF59 peut servir à la revaccination et est supérieur au vaccin sans adjuvant », affirme l’auteur, le Pr Timo Vesikari, Université de Tampere, Finlande. « Les résultats étayent le recours à un vaccin quadrivalent avec adjuvant pour la vaccination annuelle des jeunes enfants. »
Questions et réponses
Nous avons posé quelques questions à la Dre Catherine Moore, scientifique clinicienne conseil, Public Health Wales, Royaume-Uni, et à la Dre Nusrat Homaira, maître de conférences et épidémiologiste en pneumologie, University of New South Wales, Australie. Voici leurs réponses.
Q : Dans les populations humaines, les dérives antigéniques survenant dans les souches H1N1 et H3N2 sont monnaie courante. Pourquoi s’inquiète-t-on de la mutagenèse du virus dans la production sur œuf ?
Dre Catherine Moore : C’est un mésappariement causé par l’homme. En fait, on prend un virus humain qui a évolué chez l’humain, puis on l’inocule dans un système aviaire pour qu’il se réplique. On espère alors que le site de fixation à l’antigène ne sera pas perturbé pendant la réplication. Cela dit, on voit maintenant des changements au niveau du site antigénique, surtout dans la souche H3N2.
Q : Quelles sont les implications cliniques ?
Dre Catherine Moore : Les données sur l’efficacité vaccinale sont très décourageantes. Dans le cas de H3N2, l’efficacité est nulle depuis quelques saisons.
Q : Comment avez-vous réagi aux premiers résultats des essais sur les vaccins produits sur culture cellulaire ?
Dre Catherine Moore : La souche vaccinale d’un vaccin produit sur culture cellulaire ressemble beaucoup plus aux souches circulantes, et la réponse est très encourageante. Il y a de l’espoir !
Q : Pourquoi avez-vous étudié la couverture vaccinale chez les enfants ?
Dre Nusrat Homaira : Le taux d’hospitalisation pour cause de grippe est quatre fois plus élevé chez les enfants souffrant d’une maladie pulmonaire chronique que chez les enfants sans atteinte respiratoire. Or, la couverture vaccinale au sein de ce groupe n’est que de 30 à 40 %, bien que l’Australie soit un pays développé où le vaccin est recommandé et gratuit pour les enfants.
Q : Quels ont été les obstacles à la vaccination chez ces enfants à risque élevé ?
Dre Nusrat Homaira: Si les enfants viennent à la clinique du [Sydney Children’s Hospital’s] durant la saison grippale, on offre le vaccin, mais hors saison, le personnel se contente de le recommander. Aucun rappel systématique n’est envoyé aux parents durant la saison grippale.
Q : Qu’avez-vous fait et quels ont été les résultats de votre étude pilote ?
Dre Nusrat Homaira : Nous avons envoyé au groupe de référence [n = 23] des messages textes de rappel personnalisés et automatisés pour encourager les patients à se faire vacciner. Le groupe témoin [n = 23] ne recevait aucun rappel. Cette étude pilote n’était pas conçue pour faire ressortir une différence significative, mais la différence de couverture vaccinale –61 % vs
91 % – a été une augmentation absolue de 30 %. Nous nous attendions à une augmentation, mais pas d’une telle ampleur.
Q : En quoi la pratique pourrait-elle être modifiée ?
Dre Nusrat Homaira : Nous avons conclu que cette méthode pourrait facilement être intégrée dans la pratique clinique, surtout dans les pays à revenu élevé dotés de cliniques spécialisées. Cela dit, cette méthode pourrait être reproduite partout vu l’accès au téléphone intelligent. C’est vraiment bon marché ! L’envoi de messages textes deux fois par mois pendant cinq mois a coûté seulement 800 $AU plus 40 à 50 $AU par enfant pour le vaccin, par comparaison à 9000-10 000 $AU par hospitalisation.