Comptes rendus
Agonisme vs antagonisme de la LHRH : différence sur le plan cardiovasculaire maintenant prouvée par une vaste analyse groupée
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PERSPECTIVE PROFESSIONNELLE - Point de vue sur des communications présentées au Congrès multidisciplinaire ECCO-17 – ESMO 38
Amsterdam, Pays-Bas / 27 septembre-1er octobre 2013
Rédacteur invité :
Pierre I. Karakiewicz, MD
Uro-oncologue Professeur agrégé et Chercheur principal
Directeur, Unité de recherche quantitative et évaluative
Centre universitaire de l’Université de Montréal
Montréal (Québec)
Introduction
Les agonistes de l’hormone lutéinisante (LHRH) sont utilisés depuis déjà longtemps dans le traitement de première intention du cancer de la prostate (CP) sensible aux androgènes. En agissant sur les récepteurs hypophysaires de la LHRH, les agonistes de la LHRH – également appelés agonistes de la gonadolibérine (GnRH) – stimulent la libération de l’hormone lutéinisante (LH). Il en résulte d’abord une élévation du taux de testostérone qui persiste jusqu’à ce que les récepteurs de la LHRH aient été désensibilisés à l’hyperstimulation et que l’on ait obtenu un taux de castration de testostérone. Les antagonistes de la LHRH, en revanche, se fixent aux mêmes récepteurs hypophysaires de la LHRH, ce qui entraîne un blocage immédiat des actions endogènes de la LHRH. La testostérone s’en trouve supprimée immédiatement sans que la première dose ou les doses subséquentes donnent lieu à une élévation initiale des taux de gonadotrophines ou de testostérone, ce qui simule davantage l’effet de l’orchidectomie. De plus, le taux d’hormone folliculostimulante (FSH) baisse davantage sous l’effet d’un antagoniste de la LHRH : 90 % par rapport au taux initial vs environ 50 % sous agoniste de la LHRH. En tant qu’antagoniste de la LHRH de troisième génération, le degarelix est probablement le plus scruté des agents de première intention pour le CP et il a été largement comparé aux agonistes de la LHRH. Récemment, une analyse groupée de six essais cliniques où on le comparait aux agonistes de la LHRH a révélé que l’incidence des événements cardiovasculaires (CV) était plus faible au sein de la cohorte recevant l’antagoniste de la LHRH, en particulier chez les hommes qui souffraient déjà d’une maladie CV avant de participer à l’étude. Les résultats de cette analyse devraient aider à déterminer quelle classe se prête le mieux au traitement hormonal après un échec de la chirurgie ou de la radiothérapie.
Traitement hormonal et maladie CV
Un certain nombre d’études ont établi un lien entre le traitement hormonal visant à supprimer les androgènes et un risque accru de diabète et de maladie cardiovasculaire (CV), y compris une étude d’observation menée chez des vétérans atteints d’un CP dont les résultats ont été publiés par Keating et al. (JNCI 2010;102[1]:39-46). Au total, 37 443 hommes qui avaient reçu un diagnostic de CP local ou régional ont été inclus dans l’analyse. Au sein de la cohorte, 39 % avaient reçu un traitement hormonal. L’analyse a montré que le traitement par un agoniste de la GnRH était associé à une augmentation statistiquement significative du risque de diabète comparativement à l’absence de traitement hormonal : 159,4 vs 87,5 événements pour 1000 années-personnes, ce qui représente une augmentation de près de 72 % du risque de diabète associée aux agonistes de la GnRH.
La même analyse a aussi objectivé une incidence plus élevée de maladie coronarienne, d’infarctus du myocarde (IM), de mort subite cardiaque et d’AVC chez les utilisateurs d’agoniste de la GnRH que chez les non-utilisateurs. Dans une étude plus récente [Eur Urol 2013. Publication en ligne, avant l’impression, le 12 fév. 2013], Jespersen et ses collaborateurs ont analysé, au sein du registre danois des cancers, une cohorte nationale de 31 571 patients atteints d’un CP nouvellement diagnostiqué. De ces patients, 29 % avaient reçu une hormonothérapie (non précisée) alors que 7 % (n=2060) avaient subi une orchidectomie. Les résultats ont révélé que le risque d’IM et le risque d’AVC étaient environ 30 % et 20 % plus élevés, respectivement (HR ajusté de 1,31 et 1,19, respectivement) chez les patients sous hormonothérapie que chez les autres.
Contrairement aux résultats d’études antérieures, les chercheurs danois n’ont pas constaté d’augmentation du risque d’IM ou d’AVC après une orchidectomie. C’est donc dire que le traitement hormonal médicamenteux expose le patient à un risque accru de maladie CV en général, ce que la Food and Drug Administration (FDA) et les autorités canadiennes reconnaissent puisqu’elles ont exigé l’ajout d’une mise en garde dans la monographie des agonistes de la LHRH à cet égard. Durant le congrès 2013 de l’ECCO-ESMO, le Dr Bertrand Tombal, professeur titulaire d’urologie, Université Catholique de Louvain, Bruxelles, Belgique, a présenté les résultats d’une analyse groupée de six essais de phase III menés avec randomisation après l’homologation du degarelix par la FDA. Des six essais inclus dans l’analyse groupée, trois avaient duré 3 mois et les trois autres, de 7 à 12 mois. Au total, 1686 patients ont reçu une hormonothérapie pendant 1 an et 642, pendant 3 à 7 mois.
Parmi ces patients, 1491 ont reçu un antagoniste de la LHRH et les 837 autres, de la goséréline ou du leuprolide. Les groupes étaient bien appariés quant aux caractéristiques initiales et aux antécédents de maladie CV. «Les patients n’avaient jamais reçu d’hormonothérapie et étaient aptes à recevoir un agoniste ou un antagoniste de la LHRH, fait remarquer le Dr Tombal; dans la plupart des cas, les analyses biochimiques ont révélé que le cancer était réapparu après une radiothérapie ou une prostatectomie radicale.» Le score de Gleason se situait entre 7 et 10 chez la majorité des patients. Environ 20 % présentaient un cancer métastatique ou un taux initial de PSA élevé. L’analyse des événements visait à calculer la mortalité toutes causes confondues et l’incidence d’événements CV graves.
Comme l’a souligné le Dr Tombal, le risque de maladie CV était significativement plus faible chez les patients sous antagoniste de la LHRH que chez les patients sous agoniste de la LHRH. Plus précisément, l’incidence globale de tous les événements CV se chiffrait à 2,7 % sous degarelix et à 4,4 % sous agoniste de la LHRH. Seulement 1,7 % des sujets sous antagoniste de la LHRH ont eu un événement CV grave comparativement à 2,9 % des sujets sous agoniste de la LHRH (Tableau 1).
Tableau 1. Incidence globale des événements CV
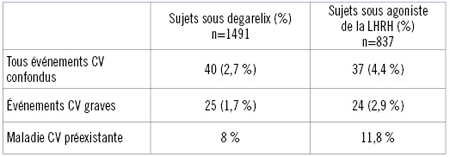
Un événement CV était qualifié de grave s’il menaçait le pronostic vital ou s’il nécessitait l’hospitalisation, précise le Dr Tombal.
Maladie CV préexistante
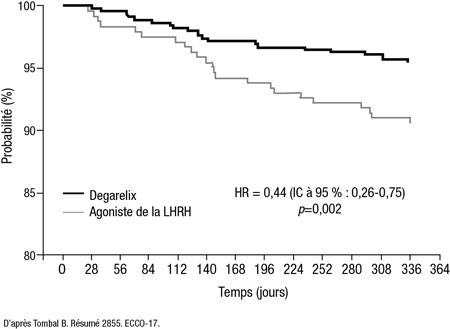
Lorsque l’analyse des événements CV ciblait uniquement les hommes qui souffraient d’une maladie CV au départ, le risque de survenue d’un événement CV ou de décès était 56 % plus faible sous antagoniste de la LHRH que sous agoniste de la LHRH (p=0,002) après 1 an (Figure 1). Même après prise en compte des variables influant sur le risque de maladie CV, la réduction du risque était de plus de 50 % chez les hommes ayant des antécédents de maladie CV au départ lorsque le traitement était un antagoniste plutôt qu’un agoniste (p=0,004), ajoute le Dr Tombal.
Figure 1. Diminution du risque d’événement CV ou de décès sous degarelix en présence d’une maladie CV préexistante
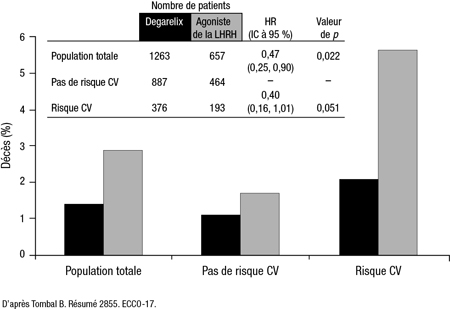
Chez les hommes qui ne souffraient pas d’une maladie CV au départ, en revanche, il n’y avait pas de différence entre les groupes quant au risque d’événement CV ou à la mortalité CV (Figure 2).
Figure 2. Mortalité en fonction du risque CV initial
Progression du taux de PSA ou décès
La même analyse groupée a révélé que le pourcentage d’hommes dont le taux de PSA avait progressé ou qui étaient décédés pendant le suivi de 1 an était plus élevé parmi les patients dont le taux de PSA était élevé au départ (à la fois >20 à 50 ng/nL et >50 ng/mL), ce qui n’a rien d’étonnant, poursuit le Dr Tombal. Cela dit, les résultats globaux sont demeurés favorables à l’antagoniste de la LHRH, surtout chez les hommes dont le taux de PSA était >50 ng/mL au départ; en effet, au sein de cette population, l’analyse groupée a révélé qu’à 1 an, le taux de survie sans progression du taux de PSA (SSP PSA) était de 66 % chez les hommes sous antagoniste comparativement à 54,7 % chez les hommes sujets sous agoniste (p=0,0245 pour un échec du taux de PSA, en faveur de l’antagoniste de la LHRH).
Si l’analyse englobait également les hommes dont le taux de PSA initial était >20 ng/mL, la probabilité de SSP PSA était 26 % plus élevée chez les hommes sous antagoniste de la LHRH que chez les témoins actifs, et l’écart a presque atteint le seuil de significativité statistique (p=0,051). Au sein de la cohorte globale, 98,3 % des hommes sous degarelix vs 96,7 % des hommes sous agoniste de la LHRH étaient en vie au terme de la première année de traitement (p=0,0329).
Voies urinaires et santé osseuse
À l’instar des études ayant objectivé des bénéfices substantiels associés à l’antagonisme de la LHRH – plus précisément, une diminution du volume de la prostate et une diminution des symptômes urinaires –, l’analyse groupée a révélé que, sous antagoniste de la LHRH, les effets indésirables sur les voies urinaires étaient significativement moins fréquents (p<0,0001) et l’intervalle précédant la survenue de la première infection urinaire était significativement plus long (p=0,001).
Fait digne de mention, le taux global de symptômes articulaires était plus faible sous degarelix que sous agoniste de la LHRH : 5,3 % vs 8,1 % (p=0,0116). La probabilité globale de fracture était aussi plus faible sous antagoniste de la LHRH que sous agoniste (<1 % vs 2 %) (p=0,0234). Chez les hommes de plus de 70 ans, le risque de fracture était 74 % plus faible sous antagoniste de la LHRH (p=0,0137), et l’incidence des douleurs musculaires et osseuses était plus faible sous antagoniste (p=0,0822).
«Dans l’ensemble, les effets indésirables étaient très similaires», indique le Dr Tombal. Les réactions au point d’injection étaient plus fréquentes sous antagoniste de la LHRH, probablement parce que la première dose du médicament est donnée en deux injections.
«Cette analyse montre que la première année de traitement par le degarelix a été associée à une incidence moindre d’effets indésirables liés à la maladie, y compris les symptômes urinaires et les fractures, et nous croyons qu’il s’agit là d’une amélioration substantielle pour les patients n’ayant jamais reçu de traitement hormonal», conclut le Dr Tombal.
Publication en ligne
Dans un article de la même analyse groupée dont la publication en ligne a précédé l’impression, Albertsen et al. (Eur Urol 2013, http://dx.doi.org/10.1016/j.eururo.2012.10.032) soulignent que chez la plupart des hommes, une simple élévation du taux sérique de PSA après une prostatectomie radicale ou une radiothérapie justifie l’instauration d’un traitement hormonal. «Par conséquent, les hommes reçoivent un traitement hormonal beaucoup plus longtemps qu’avant, de sorte que les effets indésirables associés au traitement sont maintenant mieux connus», écrivent les auteurs.
Ces effets indésirables englobent non seulement les effets bien connus du traitement hormonal mais aussi les altérations métaboliques, y compris les dyslipidémies qui contribuent au risque CV. Le Dr Tombal affirme dans une présentation en ligne (http://www.europa-uomo.org/docs/eau2013/News_ europauomo%20Tombal.pdf) qu’à la lumière des résultats de la nouvelle analyse groupée, on devrait envisager un traitement hormonal à base d’un antagoniste de la LHRH chez les patients ayant des antécédents de maladie vasculaire, le degarelix ayant pratiquement réduit de moitié le risque d’événement CV sur une période de 1 an comparativement aux agonistes de la LHRH.
Si le patient n’a pas d’antécédents de maladie CV mais qu’il a un taux de PSA >20 ng/mL, l’antagoniste devrait également être envisagé, l’analyse groupée ayant montré qu’en présence d’un taux de PSA >20 ng/mL, l’antagoniste prolongeait la SSP PSA comparativement à l’un ou l’autre agoniste.
Les hommes porteurs d’un cancer métastatique pourraient eux aussi bénéficier d’un traitement à base d’un antagoniste, le degarelix ayant été associé en pareil cas à une prolongation de la SSP PSA et à une incidence moindre de douleurs osseuses et de fractures. Enfin, les hommes ayant au départ des symptômes du bas appareil urinaire (SBAU) et un score IPSS (International Prostate Symptom Score) >12 pourraient aussi bénéficier d’un antagoniste de la LHRH, l’analyse groupée ayant objectivé un soulagement plus marqué des SBAU sous degarelix que sous leuprolide ou goséréline.
Nouvelle forme d’hormonothérapie
Des données antérieures sur le degarelix avaient déjà confirmé son efficacité en tant que nouvelle forme d’hormonothérapie dans le traitement du CP précoce. Les différences de profil pharmacologique entre les antagonistes et les agonistes de la LHRH incitent à la comparaison. Dans le cadre de l’un des essais comparatifs les plus importants (CS21), les chercheurs ont comparé l’efficacité du degarelix à celle d’un agoniste de la LHRH, le leuprolide, quant à l’obtention et au maintien d’un taux de castration de testostérone sur une période de 1 an [BJU Int 2008;102:1531-38]. Au total, 610 patients atteints d’un CP ont été randomisés de façon à recevoir soit du leuprolide à raison de 7,5 mg/mois, soit du degarelix à raison de 240 mg le premier mois, puis de 80 ou 160 mg par la suite.
Le paramètre principal était la suppression du taux de testostérone (≤0,5 ng/mL) entre les jours 28 et 364. À 1 an, la réponse au traitement était presque identique dans tous les groupes de traitement : environ 98 % pour l’antagoniste de la LHRH (deux doses) vs environ 96 % pour l’agoniste de la LHRH. Cependant, souligne le Dr Neal Shore, directeur médical, Carolina Urologic Research Center, Myrtle Beach, Floride (Ther Adv Urol 2013;5[1]:11-24), l’antagoniste de la LHRH a abaissé le taux de testostérone plus rapidement que le leuprolide sans entraîner d’élévation initiale.
En effet, au jour 3, 96 % des patients sous degarelix (peu importe la dose) avaient atteint un taux de castration de testostérone (≤0,5 ng/mL) alors qu’aucun des patients sous leuprolide ne l’avait atteint. Une revue ultérieure des données de l’essai CS21 par Tombal et al. [Eur Urol 2010;57:836-42] a aussi révélé que le risque de remontée du taux de PSA ou de décès était 34 % plus faible sous degarelix à 240/80 mg que sous agoniste de la LHRH (p=0,005). Près de la moitié des sujets de la cohorte de l’essai CS21 souffraient d’un cancer avancé, et c’est principalement dans ce sous-groupe que le taux de PSA est remonté, précise le Dr Shore.
À 28 jours, Tombal et ses collaborateurs ont aussi noté que, quel qu’ait été le stade de la maladie au départ, 59 % des patients sous degarelix avaient atteint un taux de PSA <4 ng/mL, comparativement à 34 % de leurs homologues sous leuprolide (p<0,0001). Chez les patients atteints d’un CP métastatique, le leuprolide – contrairement au degarelix - a été associé à une élévation initiale du taux de PSA, ajoutent les auteurs.
Après 1 an, les sujets de l’essai CS21 randomisés de façon à recevoir l’une ou l’autre dose d’entretien de degarelix ont continué de recevoir la même dose alors que les sujets sous agoniste de la LHRH ont été randomisés de façon à recevoir l’une ou l’autre dose d’entretien de l’antagoniste. Après un suivi d’une durée médiane de 27,5 mois, le risque de progression du taux de PSA en 1 an avait été réduit de plus de moitié chez les patients qui étaient passés du leuprolide au degarelix au terme de l’essai CS21.
Au cours de la deuxième année, le taux de SSP PSA n’a pas varié de manière significative chez les patients qui avaient continué de recevoir le schéma maintenant homologué de 240 mg/80 mg (dose initiale/dose d’entretien). L’antagoniste et l’agoniste ont tous deux été bien tolérés dans le cadre de l’essai CS21, l’incidence des effets indésirables survenant sous traitement ayant été similaire dans tous les groupes, ajoute le Dr Shore.
Aucune réaction allergique n’a été rapportée chez les hommes recevant l’antagoniste de la LHRH, mais les réactions au point d’injection ont été significativement plus fréquentes sous degarelix que sous leuprolide (p<0,001).
Comme le souligne également le Dr Shore, la baisse plus rapide du taux de testostérone sous antagoniste de la LHRH donne lieu à un soulagement plus rapide des symptômes liés au CP. L’absence d’élévation initiale du taux de testostérone sous degarelix est aussi importante, ajoute-t-il, car les symptômes qu’entraîne une élévation transitoire peuvent être graves. La prolongation de la SSP PSA observée sous degarelix comparativement au leuprolide dans l’essai CS21 ainsi que chez les hommes qui sont passés d’un agoniste à l’antagoniste, a d’importantes retombées cliniques. D’abord, la prolongation de la SSP – compatible avec le taux de PSA – donne tout lieu de croire que le traitement par un antagoniste retardera la progression du CP vers une forme résistante à la castration. Ensuite, le report de la progression signifie que l’intervalle durant lequel la morbidité physique et psychologique est minime s’en trouve prolongé.
Cela est même vrai pour les sujets de l’essai CS21 dont le taux de PSA était parmi les plus élevés, l’intervalle précédant la remontée du taux de PSA ou la mort ayant été prolongé d’environ 7 mois. Il s’agit là encore une fois d’un avantage cliniquement important du traitement par un antagoniste.
Résumé
Au Canada, le CP – le plus fréquent des cancers importants chez l’homme – représente chaque année environ le quart de tous les nouveaux cas de cancer. La Société canadienne du cancer estime qu’au cours de l’année 2013, environ 23 600 hommes auront reçu un diagnostic de CP et près de 4000 hommes seront morts d’un CP. C’est donc dire qu’en moyenne, 65 Canadiens reçoivent chaque jour un diagnostic de CP. Un diagnostic précoce et le recours précoce à l’hormonothérapie la plus efficace qui soit sont les meilleurs moyens de retarder la progression de la maladie et de prolonger la survie sans nuire à la qualité de vie pendant une période de traitement atteignant parfois de nombreuses années. La possibilité d’y arriver de façon plus sûre avec un antagoniste de la LHRH est simplement un avantage de plus de cette forme d’hormonothérapie.