Comptes rendus
D’après la déclaration du comité consultatif (DCC) du CCMTMV
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
MEDI-NEWS Prévention de la diarrhée du voyageur : stratégies de réduction du risque
décémbre 2019
En décembre 2019, le CCMTMV a publié une Déclaration sur la prévention de l’encéphalite japonaise1 pour les voyageurs du Canada, emboîtant ainsi le pas aux Centers for Disease Control and Prevention (CDC) des États-Unis qui ont publié les leurs en juillet 20192. L’encéphalite japonaise (EJ) est une maladie potentiellement mortelle transmise par des moustiques. La moitié de la population mondiale vit dans une région endémique, surtout l’Asie et le Pacifique occidental. Les cliniciens du Canada ont accès à un vaccin anti-EJ, mais il est difficile de bien conseiller les patients quant à la vaccination contre cette maladie grave et rare. La présente publication est un résumé des points à retenir de la nouvelle déclaration du CCMTMV et des publications scientifiques récentes sur les facteurs à considérer.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
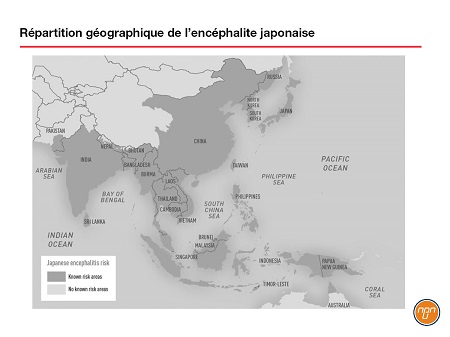
Le virus de l’encéphalite japonaise (VEJ) – dont le génome est constitué d’un ARN simple brin – fait partie du genre Flavivirus. Transmise par des moustiques du genre Culex, l’EJ est la forme la plus fréquente d’encéphalite évitable par la vaccination en Asie et dans une grande partie du Pacifique occidental. Il y aurait 70 000 cas par année, dont 20 000 seraient mortels. Le VEJ a été décrit pour la première fois au Japon dans les années 1870. Aujourd’hui, environ la moitié de la population mondiale vit dans les 24 pays et groupes d’îles où l’EJ est considérée comme endémique (Figure 1). Il n’y a aucun traitement contre la maladie, mais un vaccin prophylactique (IXIAROMD) est homologué au Canada.
Figure 1.
Étude de cas : jeune femme de 21 ans ayant contracté l’EJ après 4 semaines en Thaïlande
(d’après Turtle et al., 2019)3
En avril 2014, une femme de 21 ans non vaccinée contre le VEJ a développé un état fébrile après 4 semaines dans l’Ouest de la Thaïlande. Séjournant dans un hôtel très simple, elle a eu de nombreuses piqûres de moustique malgré l’utilisation de DEET. Trouvée inconsciente dans sa chambre d’hôtel, elle a été transportée à l’hôpital, où elle a eu des convulsions et un arrêt cardiaque, puis a été intubée. Hospitalisée pendant 4 semaines, elle s’est « bien rétablie » grâce à une neurorééducation. Après 30 jours, on l’a transférée dans un hôpital du Royaume-Uni, d’où elle a reçu son congé le lendemain. La sérologie a révélé la présence d’IgG anti-VEJ et l’absence d’IgM/IgG contre le virus de la fièvre dengue et le virus du Nil occidental. Deux ans et demi plus tard, la patiente avait toujours des difficultés cognitives, n’avait aucun souvenir ou presque de son passé, et se sentait épuisée après la moindre tâche. Elle se souvenait que le professionnel de la santé lui avait dit que le risque d’une infection par le VEJ était faible et qu’il n’avait jamais entendu parler d’un cas d’EJ. Ce cas souligne l’importance d’informer les voyageurs quant aux conséquences d’une infection par l’EJ et pas seulement du risque de la contracter, qui varie selon l’itinéraire, la durée du voyage, la saison, l’hébergement et les activités en plein air, surtout le soir et la nuit (Tableau 1. Facteurs à prendre en compte lors de l’évaluation du risque d’EJ chez un voyageur).
Tableau 1.

Caractéristiques cliniques et épidémiologiques de l’EJ
La probabilité de maladie symptomatique après l’infection par le VEJ est d’environ 1 sur 250, selon le CCMTMV. Si des symptômes apparaissent (période d’incubation de 5 à 15 jours), le pronostic est sombre : environ 20 à 30 % des patients meurent et environ 50 % des survivants ont des séquelles neurologiques/psychologiques à long terme. Vu l’absence d’antiviral spécifique, la seule solution est de prodiguer des soins de soutien et de traiter les complications. L’apparition de l’EJ est saisonnière dans les climats tempérés, la période la plus risquée étant de mai à octobre; dans les régions tropicales, le risque est présent à longueur d’année. Le VEJ se perpétue dans un cycle enzootique où interviennent des moustiques Culex et des échassiers. Les porcs et, dans une moindre mesure, d’autres animaux domestiques jouent le rôle d’hôtes amplificateurs, ce qui favorise la réplication et la transmission du virus. Le plus souvent, les humains sont infectés de par leur proximité à un « cercle amplificateur ». Le risque est donc maximal dans les régions rurales durant la saison chaude/des pluies, lorsque les moustiques sont très actifs, et entre le coucher et le lever du soleil, les moustiques Culex piquant durant la nuit. L’humain est considéré comme un hôte terminal, sa virémie étant insuffisante pour la transmission par un moustique.
Risque global faible, mais sous-populations
à risque plus élevé et incertain
Le risque de contracter le VEJ pour un Canadien qui se rend dans une zone d’endémie est considéré comme faible, mais le risque exact pour une personne donnée demeure imprévisible. Un seul cas ayant été publié entre 2006 et 2015, le CCMTMV estime que le taux d’attaque global de l’EJ chez les voyageurs du Canada est de 1 sur 11,65 millions. Dans le cas des voyageurs américains et européens (zones non endémiques) qui se rendent en Asie, on estime l’incidence globale d’EJ à moins de 1 cas pour 1 million de voyageurs. Les taux estimés sont plus élevés pour certains voyageurs ayant une destination particulière, p. ex. les voyageurs finlandais et suédois se rendant en Thaïlande (1 cas sur 257 000 et de 1 cas sur 400 000 voyageurs, respectivement)4,5. Le risque des personnes séjournant longtemps en région rurale où le VEJ est transmis activement pourrait être semblable à celui des résidents vulnérables2.
Les grandes variations rapportées quant au risque d’exposition au VEJ montrent notre compréhension bien imparfaite des risques spécifiques pour un voyageur particulier.
Épidémiologie changeante de l’EJ
Avant la publication de la déclaration du CCMTMV, de nombreux auteurs ont souligné l’importance de « cerner l’épidémiologie changeante d’une infection par le VEJ6 ». La propagation du VEJ dans de nouveaux milieux, l’évolution des pratiques agricoles et des vecteurs animaux, les changements climatiques, la croissance péri-urbaine, l’évolution des déplacements vers l’Asie, les facteurs de risque personnels ainsi que la transmission sans moustique et les interactions avec d’autres flavivirus sont autant de facteurs qui contribuent à l’épidémiologie changeante de l’EJ et aux risques pour les voyageurs6,7,8.
Vu l’absence de données probantes, le CCMTMV a été incapable d’estimer l’ampleur de l’accroissement du risque associé à ces facteurs susceptibles d’avoir un impact profond – mais encore inconnu – sur le risque apparent d’EJ pour les voyageurs canadiens. Le niveau de risque exact pour un voyageur demeure donc flou. »
Quand faut-il utiliser le vaccin anti-EJ?
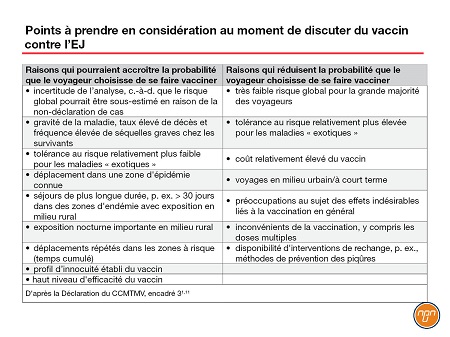
Le CCMTMV ne recommande pas l’utilisation systématique du vaccin anti-EJ lors d’un déplacement en région endémique (recommandation conditionnelle contre; confiance modérée quant à l’effet estimé).
Cette recommandation conditionnelle reflète notamment les répercussions mal définies de facteurs de risque d’EJ tels que : destination, saisonnalité, itinéraire et durée du séjour, valeurs et préférences des voyageurs (y compris la décision de payer).
Le CCMTMV reconnaît que certaines populations, p. ex. les voyageurs qui séjournent longtemps (> 30 jours) ou se rendent souvent en région d’endémie, et ceux séjournant longtemps en région rurale ou visitant une région aux prises avec une éclosion d’EJ, sont probablement plus à risque d’EJ et que les voyageurs seraient alors plus susceptibles de choisir le vaccin anti-EJ en pareils cas. Le CCMTMV fournit une liste de considérations qui pourraient influencer la décision d’opter ou non pour le vaccin anti-EJ (Tableau 2).
Aux États-Unis, l’ACIP a récemment publié ses recommandations sur l’EJ2. Ce comité recommande le vaccin anti-EJ dans les cas suivants : personnes élisant domicile, séjournant longtemps (≥ 1 mois) ou voyageant souvent en région d’endémie. Le vaccin anti-EJ devrait aussi être envisagé en cas de séjours de plus courte durée (< 1 mois) associé à un risque accru d’EJ selon la durée prévue du séjour, la saison, le lieu, les activités et l’hébergement ou en cas d’incertitude quant à la durée prévue du séjour, à la destination ou aux activités. L’ACIP estime que le vaccin anti-EJ n’est pas recommandé si l’itinéraire expose le voyageur à un risque très faible (p. ex. séjour de courte durée en région urbaine ou clairement hors saison de transmission du VEJ).
Conseiller les patients quant à l’EJ
Vu la recommandation conditionnelle du CCMTMV et la difficulté pour le clinicien de déterminer le risque exact d’EJ pour chaque voyageur, le professionnel de la santé doit présenter au patient les avantages et risques escomptés (dont le coût) pour l’aider à prendre une décision conforme à ses valeurs et préférences. La discussion doit aussi porter sur les stratégies de rechange ou complémentaires (p. ex. utilisation de mesures de protection individuelle [MPI] contre les piqûres de moustiques).
Vaccin contre l’EJ
Au Canada, IXIAROMD est le seul vaccin anti-EJ homologué (vaccin cultivé sur cellules Vero et inactivé, indiqué à partir de l’âge de 2 mois). Le CCMTMV souligne l’importance de consulter la monographie d’IXIAROMD9 et le Guide canadien d’immunisation10 avant de le donner.
Tant chez l’adulte que chez l’enfant, le schéma de primovaccination par IXIAROMD comporte deux doses administrées le jour 0 et le jour 28. Si des contraintes de temps font obstacle à la primovaccination, un schéma accéléré est possible chez les 18 à 65 ans : 1re dose le jour 0 et 2e dose le jour 7. Le CCMTMV suggère aussi une dose de rappel unique de 12 à 24 mois après la primovaccination, avant une nouvelle exposition au VEJ. Des données indiquent qu’après la dose de rappel, on obtient une réponse immunitaire appropriée durable chez les adultes. Selon le CCMTMV, si une protection soutenue est désirée, aucune autre dose de rappel n’est nécessaire avant au moins 10 ans.
Conclusion
La Déclaration sur la prévention de l’encéphalite japonaise du CCMTMV aide le clinicien à composer avec cette maladie rare, imprévisible et potentiellement mortelle pour les voyageurs canadiens. La pertinence de la vaccination anti-JE est difficile à évaluer pour un clinicien, qui doit soupeser le faible risque de contracter la maladie, l’incertitude entourant les facteurs de risque, les conséquences potentiellement très graves de l’EJ, les effets indésirables possibles du vaccin et le coût de la vaccination. Pour prendre sa décision, le voyageur doit tout savoir du vaccin et de la maladie, y compris ses effets rares mais dévastateurs6.
Tableau 2.
Questions et réponses
Nous avons posé quelques questions au Dr Darin P. Cherniwchan, BSc(Pharm), MD, CM, CCFP, CTH, FCFP, directeur médical de la Fraser Valley Travel Clinic et membre de la faculté de médecine, University of British Columbia, et de la faculté des études sur la santé, University of the Fraser Valley. Voici ses réponses.
Q : Que dites-vous au sujet de l’EJ au patient qui se rendra en zone d’endémie?
Dr Cherniwchan : Je lui demande d’abord s’il connaît les maladies transmises par les moustiques (MTM) auxquelles il sera exposé pendant ce voyage. S’il répond que non, j’énumère les principaux types de virus/parasites de cette région. J’explique que l’on peut réduire ce risque grâce à la vaccination et à l’utilisation de mesures de protection individuelle (MPI), tels les répulsifs sur la peau et la perméthrine sur les vêtements. S’il répond que oui, je vérifie ses connaissances. Souvent, les voyageurs surestiment le risque de malaria et sous-estiment le risque de MTM comme la fièvre dengue, le chikungunya et l’EJ. Une fois que le voyageur comprend les risques réels, je passe en revue les options vaccinales et les MPI. En tant que professionnel de la santé, j’estime qu’il m’incombe de soupeser le pour et le contre (dont le coût) du vaccin anti-EJ avec chaque voyageur se dirigeant en zone d’endémie pour qu’il prenne une décision éclairée.
Q : En quoi la nouvelle déclaration du CCMTMV changera-t-elle votre approche?
Dr Cherniwchan : La déclaration du CCMTMV confirme ce que je fais depuis toujours pour la prévention de cette maladie rare mais possiblement mortelle. Souvent, chez les survivants, des séquelles neurologiques graves et débilitantes persistent à vie. Le vaccin est très sûr, et je le recommande à ceux qui prévoient séjourner en zone d’endémie pendant au moins 4 semaines (voyage unique ou durée cumulative). L’économie de la santé est un facteur réel : si le vaccin est couvert par une assurance médicale, la décision est plus facile, mais les voyageurs n’ayant pas d’assurance décident souvent de payer le vaccin de leur poche si le risque cumulatif excède 30 jours ou s’ils prévoient des activités extérieures de longue durée en zone rurale, surtout le soir ou la nuit. Pour améliorer le rapport coût-bénéfice du vaccin, si un autre séjour en zone d’endémie est très probable ou prévu, une 3e dose peut être offerte de 12 à 24 mois après les 2 premières doses pour offrir une protection supplémentaire de 10 ans. Cet effet « lance-pierres» – propre à IXIAROMD – aide souvent le voyageur à prendre la décision de se faire vacciner, à plus forte raison s’il prévoit retourner en zone d’endémie.
Q : Le CCMTMV estime que le voyageur urbain est moins vulnérable. Cela dit, selon trois articles récents6,7,8, la tendance à installer des parcs d’affaires en zone péri-urbaine en Asie comporte de réels dangers. Que conseillez-vous aux personnes qui voyagen affaires ?
Dr Cherniwchan : L’EJ et ses effets chez les voyageurs passent souvent sous le radar. Au vu des pratiques agricoles changeantes et de l’apparition de centres péri-urbains, l’épidémiologie devient très dynamique et le risque, imprévisible. Nombreux sont les voyageurs canadiens qui se rendent dans des parcs d’affaires péri-urbains, et il est fréquent qu’ils ne soient pas au courant des risques, qu’ils n’utilisent pas de MPI et que le voyage soit une décision de dernière minute ou presque. Autre tendance : ils retournent souvent aux mêmes destinations à risque, ce qui vient amplifier leur risque cumulatif.
Q : En résumé, quels sont les patients qui auraient le plus/le moins intérêt à recevoir un vaccin anti-EJ ?
Dr Cherniwchan : En général, je ne recommande pas le vaccin anti-EJ aux personnes qui optent pour des MPI et qui séjourneront peu de temps (< 30 jours) et exclusivement en zone urbaine et à celles qui font de brèves escales en croisière. Voici la liste des voyageurs qui ont le plus intérêt à recevoir IXIAROMD :
1. Personnes qui se rendent en zone d’endémie et dont le risque cumulatif excède 30 jours (voyage unique ou voyages répétés).
2. Personnes se rendant dans une zone où l’activité de transmission est accrue.
3. Expatriés.
4. Personnes prévoyant des activités en plein air de longue durée (p. ex. camping, randonnée pédestre, vélo) en zone rurale, surtout le soir ou la nuit.
5. Routards, personnes dont l’itinéraire est improvisé ou séjournant dans un lieu sans climatisation, sans moustiquaire de fenêtre ni moustiquaire de lit.
6. Personnes qui rendent visite à des amis ou à des parents, surtout en milieu rural. En général, ces voyageurs sous-estiment grandement le risque et prennent moins de précautions.
7. Personnes susceptibles de se rendre sur une ferme, en milieu rural ou péri-urbain.
Références :
1. Déclaration sur la prévention de l’encéphalite japonaise. Comité consultatif de la médecine tropicale et de la médecine des voyages (CCMTMV) et Agence de la santé publique du Canada (ASPC). Publiée en déc. 2019. https://www.canada.ca/fr/sante-publique/services/ccmtmv/declaration-prevention-encephalite-japonaise.html.
2. Hills SL, Walter EB, Atmar RL, Fischer M. Japanese Encephalitis Vaccine: Recommendations of the Advisory Committee on Immunization Practices. MMWR Recomm Rep. 2019; 68(No.2):1–33.
3. Turtle L et al. ‘More than devastating’ – patient experiences and neurological sequelae of Japanese encephalitis. J Travel Med. 2019; 26:1–7.
4. Lehtinen VA, Huhtamo E, Siikamaki H, Vapalahti O. Japanese encephalitis in a Finnish traveler on a two-week holiday in Thailand. J Clin Virol. 2008; 43:93-5.
5. Buhl MR, Lindquist L. Japanese encephalitis in travelers: review of cases and seasonal risk. J Travel Med. 2009; 16:217-9.
6. Connor BA et al. Japanese encephalitis vaccine for travelers: risk-benefit reconsidered. J Travel Med. 2019; 26:1–3.
7. Connor B, Bunn WB. The changing epidemiology of Japanese encephalitis and new data: the implications for new recommendations for Japanese encephalitis vaccine. Trop Dis Travel Med Vaccine. 2017; 3:14-9.
8. Lindquist L. Recent and historical trends in the epidemiology of Japanese encephalitis and its implication for risk assessment in travellers. J Travel Med. 2018; 25:Suppl.1,S3–S9.
9. Valneva Autriche GmbH. Monographie d’IXIARO. 2018.
10. Agence de la santé publique du Canada. Guide canadien d’immunisation: Partie 4 – Agents d’immunisation active. 2014; Pour consultation : https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active/page-11-vaccin-contre-encephalite-japonaise.html.
11. Hatz C et al. Japanese encephalitis: defining risk incidence for travelers to endemic countries and vaccine prescribing from the UK and Switzerland. J. Travel Med. 2009; 16:200-3.