Comptes rendus
De nouveaux horizons dans le traitement de l’hémophilie A et B
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
FRONTIÈRES MÉDICALES - du XXIVe Congrès de l’International Society of Thrombosis and Haemostasis (ISTH) et de la 59e Assemblée annuelle du Scientific and Standardization Committee (SCC)
Amsterdam, Pays-Bas / 29 juin-4 juillet 2013
Amsterdam - À l’heure actuelle, l’hémophilie se traite par l’injection intraveineuse de concentrés de facteurs de coagulation, pratiquée à la demande – en cas d’hémorragie – ou à titre prophylactique. Depuis l’avènement des produits recombinants, le traitement de référence repose davantage sur la prophylaxie. Malgré des progrès quant à l’innocuité du traitement et de la prise en charge des hémorragies, les produits à notre disposition ont plusieurs défauts, notamment une courte demi-vie, le développement fréquent d’inhibiteurs qui neutralisent l’effet des facteurs de substitution, et la nécessité d’abords veineux répétés. La production de facteurs de coagulation dotés d’une demi-vie plus longue et d’une immunogénicité moindre, rendue possible par l’évolution de la technologie de l’ADN recombinant, permet d’améliorer le traitement de substitution. Les modifications chimiques (pégylation et polysialylation) et la fusion de protéines comptent parmi les stratégies ciblées issues du génie biomédical. Des essais cliniques ont déjà révélé qu’un certain nombre de nouveaux produits permettaient d’allier innocuité, demi-vie prolongée et élimination différée; les plus avancés sont en attente d’une homologation dans plusieurs pays. Les plus récentes données sur l’utilisation de certains de ces produits dans le traitement de l’hémophilie ont été présentées au congrès.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
À l’heure actuelle, l’hémophilie se traite par la perfusion de concentrés de facteurs de coagulation en cas d’hémorragie (traitement à la demande) ou pour la prévention d’épisodes hémorragiques (prophylaxie). Grâce à l’avènement de produits recombinants plus sûrs, le traitement – jadis axé sur la prise en charge des épisodes hémorragiques aigus – en est venu à reposer davantage sur la prévention de tels épisodes et la prise en charge des complications de la maladie. Dans l’hémophilie sévère, la prophylaxie est devenue la norme, et on l’amorce idéalement à un très jeune âge – typiquement entre 1 et 3 ans –, avant l’apparition d’hémarthroses sévères. À l’heure actuelle, les patients atteints d’hémophilie A reçoivent du rFVIII 3 ou 4 fois par semaine et les patients atteints d’hémophilie B, du rFIX 2 ou 3 fois par semaine, l’objectif étant le maintien d’un taux circulant de FVIII ou de FIX supérieur à 1 % de la normale (1 UI/dL), ce qui suffit à protéger le patient contre la plupart des épisodes hémorragiques spontanés. Cela dit, malgré leurs profils d’efficacité, de tolérabilité et d’innocuité favorables, les produits recombinants actuels confèrent une protection hémostatique lacunaire à bien des égards : d’abord, le développement d’inhibiteurs rend le traitement inefficace chez environ 30 % des patients atteints d’hémophilie A sévère et 1 à 3 % des patients atteints d’hémophilie B; deuxièmement, ils ont une courte demi-vie : 8 à 12 heures pour le rFVIII et 18 à 24 heures pour le rFIX; troisièmement, leur administration intraveineuse fréquente requiert des abords veineux répétés. Les injections fréquentes nécessaires à un traitement prophylactique rigoureux représentent un fardeau pour les patients qui peut nuire à l’adhésion au traitement et à la qualité de vie. L’adhésion aux schémas prophylactiques est médiocre dans de nombreux groupes d’âge (Berntorp E.
Hemophilia 2009;15:1219-27), et l’hémophilie demeure associée à un important fardeau de morbidité (Fogarty PF. Hematology Am Soc Hematol Educ Program 2011:1:397-404).
De nouveaux traitements dont l’effet est plus durable pourraient non seulement accroître le recours à la prophylaxie, mais aussi améliorer l’adhésion au traitement et les résultats cliniques. Des facteurs de substitution qui exercent un effet durable pourraient réduire la fréquence des perfusions au point où il ne serait plus nécessaire d’implanter une chambre chez les jeunes enfants, sans compter qu’un nombre moindre de doses et une plus grande flexibilité pourraient améliorer l’observance du traitement et l’adhésion aux schémas prescrits. La pharmacocinétique (PK) plus favorable des facteurs de substitution dont l’effet est plus durable pourrait diminuer encore la morbidité qui découle d’hémarthroses récurrentes et ainsi améliorer la qualité de vie des patients hémophiles. Les chercheurs travaillent sans relâche depuis déjà longtemps pour prolonger la demi-vie du rFVIII et du rFIX et ainsi améliorer le traitement. La technologie des protéines de fusion consiste en l’association d’un facteur de coagulation avec une protéine dotée d’une demi-vie plasmatique beaucoup plus longue, par exemple le fragment cristallisable (Fc) de l’immunoglobuline G (IgG) ou l’albumine. La fusion génétique du Fc des immunoglobulines humaines IgG1 utilise la voie des IgG endogènes dans laquelle le Fc se fixe au récepteur néonatal du Fc (FcRn), ce qui protège les molécules à Fc du catabolisme, facilite leur recyclage et prolonge ainsi leur demi-vie plasmatique. Le rFVIII-Fc et le rFIX-Fc (Biogen Idec) – deux protéines de fusion Fc d’effet durable qui résultent de la liaison covalente d’une molécule unique de rFVIII ou de rFIX et du Fc des IgG1 – sont produits dans des cellules HEK 293 sans intron, permettant ainsi une glycosylation semblable à ce que l’on observe chez l’humain. Ces protéines de fusion ont déjà été soumises aux autorités sanitaires de plusieurs pays pour homologation dans le traitement de l’hémophilie A et B. L’albumine est la protéine la plus abondante dans le corps humain, et la fusion génétique des facteurs de coagulation et de l’albumine pourrait prolonger la demi-vie de ces derniers. Le CSL654 (CSL Behring) est issu de la fusion génétique de l’albumine et de l’extrémité C-terminale d’un FIX recombinant (rFIX) par l’intermédiaire d’un peptide de liaison clivable dérivé de la séquence d’activation du FIX.
La pégylation – méthode de modification chimique reposant sur l’utilisation du polyéthylène glycol (PEG) – du rFVIII et du rFIX est une autre stratégie de prolongation de la demi-vie à l’étude. La liaison covalente entre le PEG et des groupements de surface libres sur la protéine – que cette liaison soit aléatoire, qu’elle résulte de la fixation d’un site particulier à des résidus cystéine libres ou qu’elle soit le fruit du génie protéique – améliore l’efficacité des médicaments. Cette amélioration s’expliquerait par une augmentation de la masse moléculaire, une diminution de la filtration glomérulaire résultant du masquage de la surface protéique, et une diminution de la réponse d’immunoreconnaissance. La pégylation des protéines est largement reconnue comme une méthode sûre et bien tolérée. Plusieurs composés pégylés font actuellement l’objet d’essais cliniques dans le traitement de l’hémophilie A, notamment : le BAX855 (Baxter), conjugué d’un rFVIII pégylé résultant de la modification d’un rFVIII pleine longueur; le BAY 94-9027 (Bayer), rFVIII sans domaine B sur lequel on a fixé une molécule de PEG à un site spécifique; le N8-GP (Novo Nordisk), rFVIII glycopégylé dont le PEG cible un O-glycane dans le domaine B tronqué; le N9-GP (Novo Nordisk), un rFIX glycopégylé dont le PEG est conjugué au peptide d’activation du FIX.
Protéine de fusion rFVIII-Fc
L’hémophilie A, le plus fréquent des troubles héréditaires de la coagulation, représente 80 à 85 % des cas d’hémophilie et frappe 1 homme sur 5000. Elle se caractérise par un déficit important ou complet en FVIII. Pour la première fois depuis l’avènement du rFVIII il y a 20 ans, de nouvelles molécules voient le jour dans le traitement de l’hémophilie A. Le Dr J. Mahlangu, directeur du Haemophilia Comprehensive Care Center (HCCC), University of Witwatersrand, et du NHLS, Johannesburg, Afrique du Sud, a présenté au congrès les résultats d’un essai de phase III sur un nouveau rFVIII-Fc exerçant un effet durable. L’essai multinational A-LONG mené en mode ouvert regroupait 165 hommes (âge médian : 30 ans) atteints d’hémophilie A sévère déjà traitée qui n’avaient pas d’antécédents d’inhibiteurs anti-FVIII. Pendant 30,5 semaines (médiane), les sujets ont reçu une prophylaxie individualisée (25-65 UI/kg de rFVIII-Fc
tous les 3 à 5 jours), une prophylaxie hebdomadaire (65 UI/kg) ou un traitement épisodique (10-50 UI/kg). Les paramètres PK mesurés dans un sous-groupe séquentiel de 28 patients recevant une prophylaxie individualisée étaient comparables à ceux d’un essai de phase I/II (Powell JS et al. Blood 2012;119:3031-7) et témoignaient d’une amélioration systématique par rapport au rFVIII (Advate). La demi-vie d’élimination du rFVIII-Fc (19,0 h) était 50 % plus longue que celle du rFVIII (12,4 h). L’intervalle moyen précédant le retour à une activité du FVIII de 1 % après l’administration de 50 UI/kg de rFVIII-Fc était de 4,9 jours vs 3,3 jours pour le rFVIII. La dose médiane qu’ont reçue les patients sous prophylaxie individualisée était de 77,9 UI/kg/semaine à un intervalle inter-doses de 3,5 jours; au cours des 3 derniers mois de l’étude, l’intervalle inter-doses était passé à 5 jours (médiane) chez 30 % des sujets. «La prolongation du profil PK confirmée par cette étude ouvre la porte à de nouvelles possibilités pour la prise en charge des patients», estime le Dr Mahlangu.
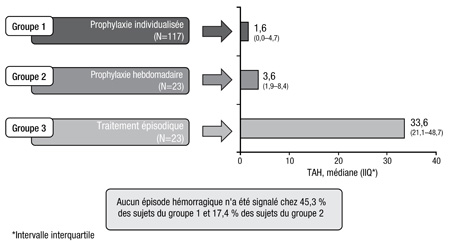
La médiane du taux annualisé d’hémorragies (TAH) était significativement plus faible chez les patients sous prophylaxie individualisée et hebdomadaire : 1,6 et 3,6, respectivement, vs 33,6 pour le traitement épisodique (Figure 1); de plus, 45,3 % des patients sous prophylaxie individualisée et 17,4 % des patients sous prophylaxie hebdomadaire n’ont eu aucun épisode hémorragique. Ces résultats ne variaient pas selon le schéma reçu avant l’étude, les hémorragies survenues au cours des 12 mois précédant l’étude ou le nombre d’articulations cibles.
Figure 1. Paramètre principal : Taux annualisés d'hémorragies (TAH)
«Il n’existe pas de traitement de référence universellement recommandé pour les épisodes hémorragiques aigus chez les patients atteints d’hémophilie A», reconnaît la Dre A. D. Shapiro, Indiana Hemophilia & Thrombosis Center, Indianapolis. Les recommandations pour le traitement initial et le traitement d’entretien dépendent de l’état clinique du patient, des taux initiaux de facteurs, de la PK de la population et du patient lui-même ainsi que des ressources économiques régionales (Document n° 179 du MASAC de la NHF, 2007). À en juger par des études sur les traitements actuels, le taux de résorption des hémorragies est d’environ 71 à 81 % après une injection unique. Dans le cadre de l’essai A-LONG, 757 épisodes hémorragiques – des hémorragies articulaires spontanées pour la plupart chez les patients sous traitement épisodique – ont été évalués chez 106 sujets inscrits à l’étude A-LONG. La plupart des hémorragies (74,6 %) ont été traitées dans un délai de 8 h suivant leur survenue. La quasi-totalité des hémorragies (97,7 %) se sont résorbées après 1 ou 2 injections de rFVIII-Fc; une injection unique de rFVIII-Fc a suffi à résorber l’hémorragie dans 87,3 % des cas. «Il s’agit là d’une amélioration par rapport aux résultats d’un essai récent sur le rFVIII dont les sujets ont été plus nombreux à avoir besoin d’un nombre plus élevé de perfusions», note la Dre Shapiro (Valentino LA et al. J Thromb Haemost 2012;10:359-67). Ces résultats étaient constants dans tous les groupes de traitement et chez les sujets inobservants. Le nombre médian d’injections requises pour la résorption d’un épisode hémorragique était systématiquement de 1,0 dans tous les groupes de traitement, quels qu’aient été le type ou l’emplacement de l’hémorragie, et le moment de l’administration du traitement. La dose médiane par injection requise pour la résorption de l’hémorragie a atteint 27,4 UI/kg, ce qui se compare à la dose totale médiane (28,2 UI/kg). Les doses requises pour le traitement des hémorragies spontanées et traumatiques étaient similaires. Selon l’autoévaluation des patients, la réponse au traitement par le rFVIII-Fc était excellente ou bonne pour 78,1 % des injections. Dans leur évaluation globale de la réponse au schéma du rFVIII-Fc attribué, les médecins ont qualifié la réponse d’excellente ou d’efficace chez 99,3 % des sujets. «Ces données viennent étayer les principaux résultats de l’essai A-LONG sur le plan de l’efficacité», conclut la Dre Shapiro. «Le profil d’effets indésirables (EI) concordait généralement avec le profil auquel on s’attendrait chez des patients atteints d’hémophilie A», note pour sa part le Dr Mahlangu.
Le rFVIII-Fc a été bien toléré, les EI les plus fréquents ayant été la rhinopharyngite, les arthralgies, les céphalées, et les infections des voies respiratoires supérieures. Un seul cas d’éruption cutanée légère iatrogène a entraîné l’abandon du traitement. Aucun cas d’anaphylaxie ou de thrombose vasculaire grave n’a été signalé. Aucun EI grave n’a été lié au rFVIII-Fc. Enfin, aucun patient n’a développé d’inhibiteurs en présence du rFVIII-Fc.
Un rFVIII monocaténaire expérimental (rVIII-SingleChain; CSL627) associé à une demi-vie plus longue que celle de l’octocog alfa est bien toléré chez les patients atteints d’hémophilie A sévère, à en juger par les données de l’essai AFFINITY. La Pre Ingrid Pabinger-Fasching, MD, École de médecine de Vienne, Autriche, a expliqué que le rFVIII monocaténaire contient une liaison covalente entre les chaînes légère et lourde que l’on trouve dans d’autres rFVIII. Lors de la première partie de l’essai de phase I/III, 27 hommes atteints d’hémophilie A sévère ont reçu une perfusion unique (50 UI/kg) d’octocog alfa ou de rFVIII monocaténaire. L’évaluation des paramètres PK sur une période de 72 h a fait ressortir une demi-vie moyenne de 14,1 h
pour le rVIII monocaténaire vs 12,1 h pour l’octocog alfa. La clairance moyenne a atteint 2,60 mL/h/kg vs 3,18 mL/h/kg, respectivement. L’ASC0-last moyenne a été de 20,2 vs 17,0 h*UI/mL. Le rFVIII monocaténaire a été généralement bien toléré. Ces données semblent indiquer que, du fait de sa demi-vie plus longue, il pourrait répondre à un besoin dans le traitement de l’hémophilie A, fait remarquer la Pre Pabinger-Fasching.
Prise en charge périopératoire
Chez un patient atteint d’hémophilie A qui subit une intervention majeure, on recommande de maintenir un taux de facteur de substitution de 80 à 100 % en période périopératoire et de poursuivre le traitement en période postopératoire de façon à maintenir un taux de FVIII de 20 à 40 % (Srivastava A et al. Haemophilia 2013;19:e1-47). Le Dr Mahlangu a présenté de nouvelles données provenant d’un sous-groupe de 9 patients qui ont subi une intervention majeure, une arthroplastie le plus souvent, durant l’essai A-LONG. «Il est difficile de maintenir une hémostase appropriée durant une intervention», reconnaît-il. Chez ces sujets, ce sont le chercheur et le chirurgien qui ont déterminé la dose en tenant compte de l’état clinique du patient, du type de chirurgie et du profil PK du rFVIII-Fc. L’hémostase a été maintenue efficacement durant la totalité des 9 interventions, ce qui donne à penser que l’hémostase périopératoire obtenue après la perfusion du rFVIII-Fc est comparable à ce que l’on observerait chez des patients non hémophiles subissant une intervention similaire. Les chercheurs et les chirurgiens ont qualifié l’hémostase périopératoire obtenue avec le rFVIII-Fc d’«excellente» ou de «bonne» dans les 9 cas. Une injection unique de rFVIII-Fc (dose médiane de 51,4 UI/kg) a suffi à maintenir l’hémostase jusqu’à la fin de la chirurgie. «Au début, les patients avaient besoin d’une forte dose, mais la dose diminuait progressivement au fil de la période postopératoire», souligne le Dr Mahlangu. Le jour même de l’intervention, la dose quotidienne médiane de rFVIII-Fc était de 80,6 UI/kg, mais elle est passée à 53,8 UI/kg pour les jours 1 à 3 et à 35,2 UI/kg pour les jours 4 à 14 après l’intervention. «Ces résultats sont manifestement de loin supérieurs à ceux que l’on observe normalement dans le cadre d’un essai clinique. Le nombre d’injections et les doses requises étaient bien inférieurs à ce que l’on a rapporté dans d’autres essais», fait valoir le Dr Mahlangu. La perte de sang médiane a été estimée à 15,0 mL durant l’intervention et à 0 mL après l’intervention (drainage postopératoire). «Il importe ici de souligner que la perte de sang peropératoire et postopératoire était comparable aux pertes observées lors d’interventions similaires chez des patients non hémophiles», précise le Dr Mahlangu. Aucun sujet n’a signalé d’épisode hémorragique durant la période postopératoire et la réadaptation. Au total, sept EI ont été signalés chez 4 sujets, et tous ont été considérés comme non liés au traitement par le rFVIII-Fc. «Fait digne de mention, aucun des patients opérés n’a développé d’anticorps neutralisants», poursuit le Dr Mahlangu, ajoutant que les chercheurs avaient fait affaire avec un laboratoire local pour la surveillance de l’activité du FVIII et que tout s’était bien passé. «Le rFVIII-Fc est un nouveau médicament, et nous craignions que les techniciens d’un laboratoire local ne se sentent pas à l’aise de faire les dosages. La comparaison des dosages locaux et des dosages centraux a révélé qu’elles étaient presque identiques. C’est donc dire que la surveillance peut se faire localement», conclut-il.
Modèle pharmacocinétique
On a appliqué aux sujets de l’essai A-LONG qui allaient être opérés un nouveau modèle PK de population mis au point pour faciliter la détermination et l’ajustement des doses du rFVIII-Fc dans le traitement de l’hémophilie A. De l’avis du Dr Mahlangu et de ses collaborateurs, ce modèle est particulièrement utile pour la détermination des doses nécessaires à l’obtention de la forte activité plasmatique du FVIII requise dans le cadre de la prise en charge périopératoire des patients hémophiles (Srivastava A et al. Haemophilia 2013;19:e1-47). Le modèle bicompartimental a été élaboré à l’aide des données initiales de 16 sujets de l’essai de phase I/IIa et de 164 sujets de l’essai de phase III A-LONG sur le rFVIII-Fc. La première analyse PK de la population a révélé que le modèle reflétait fidèlement le profil activité-temps du rFVIII-Fc observé dans les deux études et que la concentration du facteur de von Willebrand (FVW) était la covariable la plus importante pour la clairance du FVIII. À en juger par la comparaison à un modèle similaire élaboré à partir d’essais cliniques sur le rFVIII, la clairance du rFVIII était 53 % plus élevée que celle du rFVIII-Fc, ce qui témoigne d’une activité plus durable du rFVIII-Fc. La variabilité interindividuelle était assez faible, ce qui souligne la constance et l’homogénéité des profils d’activité. Une faible variabilité interoccasionnelle indiquait que l’activité du rFVIII-Fc demeurait stable et prévisible lorsque le produit était administré à long terme. Lorsqu’on a appliqué le modèle aux sujets de l’essai A-LONG qui allaient être opérés pour prédire l’activité du rFVIII-Fc durant l’intervention chirurgicale, l’activité du FVIII observée durant la période périopératoire était bien corrélée avec l’activité prédite à partir du modèle PK reposant sur les données PK préopératoires des patients. Le modèle a permis d’évaluer l’effet de diverses doses sur les activités maximale, minimale et moyenne du FVIII. Ce modèle pourra être utilisé et revalidé dans le contexte d’une intervention chirurgicale ou de toute autre intervention requise chez ces patients», estime le Dr Mahlangu.
rFVIII à longue durée d’action vs à courte durée d’action
À défaut d’essais cliniques comparatifs, on a recours à des modèles mathématiques pour quantifier les doses utilisées à titre prophylactique et les effets des préparations de rFVIII à longue durée d’action (LDA) comparativement aux préparations à courte durée d’action (CDA) dans l’hémophilie A. «Comme il est très difficile pour les tiers-payeurs de calculer les conséquences de l’introduction de tels produits, ils se servent de ces modèles, explique A. H. Miners, Ph.D., département de la recherche et des politiques sur les services de santé, London School of Hygiene and Tropical Medicine, Royaume-Uni. M. Miners et ses collaborateurs ont mis au point un modèle simple d’analyse décisionnelle afin de prévoir l’utilisation prophylactique de FVIII et les effets de cette utilisation avec des préparations de rFVIII-Fc et de FVIII-CDA. En appliquant ce modèle aux sujets de l’essai A-LONG, ils ont constaté que l’utilisation d’une préparation de rFVIII dotée d’une demi-vie plus longue pourrait réduire le nombre d’injections requises et l’utilisation globale de facteurs, sans pour autant compromettre l’efficacité hémostatique. Le modèle était adapté à partir de deux modèles PK de préparations de FVIII-CDA élaborés par Collins et al. (Cardiff University, Royaume-Uni) (Collins PW et al. J Thromb Haemost 2009;7:413-40; 2010;8:269-75), qui ont en commun avec le nouveau modèle l’utilisation des données de demi-vie des sujets adultes de l’essai A-LONG. Le modèle tenait compte de la dose, de l’intervalle inter-doses, de la demi-vie et de l’adhésion, et les résultats ont été projetés sur une période de 1 an pour un sujet de 30 ans qui recevrait une préparation de FVIII-CDA ou une préparation de rFVIII-Fc à raison de 37,5 UI/kg perfusée 2 ou 3 fois par semaine, respectivement. Les résultats de l’analyse semblent indiquer que les deux produits seraient associés à une fréquence similaire d’hémorragies (deux hémorragies par année), mais le besoin de facteurs de coagulation serait 33 % moins élevé avec le rFVIII-Fc qu’avec le FVIII-CDA. Cet effet se maintenait à long terme, ce qui permet de prévoir l’épargne de 4,6 millions d’UI de rFVIII-Fc sur une période de 30 ans en cas d’utilisation du rFVIII-Fc. En appliquant au modèle les données de l’essai A-LONG – qui reflètent mieux les schémas posologiques des essais cliniques actuels –, les chercheurs ont observé, à fréquence égale d’hémorragies, une épargne de 0,2 million d’UI lorsque le rFVIII-Fc était utilisé. «Évidemment, nous savions que nous allions observer une utilisation moindre de facteurs de coagulation, mais c’est l’ampleur de la différence qui nous intéressait», affirme M. Miners. Ces résultats sont issus non pas d’un essai clinique, mais d’un modèle mathématique, prévient-il. «La quantité de facteurs de coagulation utilisée est en fait intimement liée à la demi-vie, à l’horizon temporel et au schéma posologique; il y a donc des centaines de combinaisons possibles que l’on peut explorer dans ce modèle. Il n’y a pas de recette universelle pour la prophylaxie, et c’est d’ailleurs l’un des problèmes auxquels on se heurte quand on élabore un tel modèle, dit-il. Cependant, le modèle donne tout lieu de croire que le recours à des préparations de rFVIII-LDA pourrait avoir pour corollaire une utilisation nettement moindre de facteurs de coagulation sans pour autant augmenter le taux d’hémorragies», conclut-il.
rFVIII dérivé d’une lignée cellulaire humaine
La Dre Ri Liesner, directrice du Centre d’hémophilie, Great Ormond Street Hospital for Children, Londres, Royaume-Uni, a présenté un essai clinique en cours sur un rFVIII dérivé d’une lignée cellulaire humaine (rhFVIII, Octapharma) sans domaine B que l’on produit dans des cellules de rein embryonnaire humain (HEK, pour human embryonic kidney) 293F. Le rhFVIII – premier rFVIII à faire l’objet de modifications post-traductionnelles de type humain – ne renferme pas les résidus antigéniques (p. ex., NeuGc ou Gal-alpha1,3-Gal) présents dans les préparations de rFVIII dérivées de lignées cellulaires non humaines, telles les lignées CHO ou BHK. Vu l’absence des épitopes immunogènes présents dans les concentrés de FVIII recombinants de lignées cellulaires de hamster, on croit que le rhFVIII pourrait être moins immunogène. Cinq essais prospectifs réalisés chez 135 adultes et enfants atteints d’hémophilie A
sévère ont révélé qu’il était bioéquivalent au rFVIII-FS (tous deux évalués à l’aide de l’analyse de coagulation en une étape et de l’épreuve chromogène) et efficace dans le traitement et la prophylaxie des épisodes hémorragiques. Lors de ces études, aucun effet grave n’a été lié au produit, et aucun des patients traités antérieurement n’a développé d’inhibiteurs. Dans le cadre de deux essais de phase II/III qui regroupaient 54 adultes déjà traités pour une hémophilie A sévère et n’ayant pas d’antécédents d’inhibiteurs, 1016 épisodes hémorragiques ont été traités, et la plupart n’ont nécessité qu’une perfusion (91,4 %) ou deux (5,8 %). La dose médiane pour le traitement d’un épisode hémorragique était de 30,9 UI/kg. Chez 94,4 % des patients, l’efficacité a été qualifiée d’«excellente» ou de «bonne». Aucun EI iatrogène «grave» ou «sévère» ni aucune réaction allergique n’ont été signalés. Dans l’essai clinique prospectif en cours mené en mode ouvert à l’échelle internationale, on évalue l’immunogénicité du produit chez des patients atteints d’hémophilie A sévère qui n’avaient jamais été exposés à un concentré de FVIII ou à un produit contenant du FVIII. Au nombre des paramètres secondaires figurent l’efficacité du rhFVIII pour le traitement prophylactique, le traitement des hémorragies et la prophylaxie chirurgicale. On évaluera également l’innocuité et la tolérabilité du produit, de même que les aspects pharmacoéconomiques du traitement. L’étude devrait se terminer en 2018. D’ici là, les autorités européennes étudient le dossier du rhFVIII en prévision d’une homologation pour le traitement de l’hémophilie A.
Protéine de fusion rFIX-Fc
L’hémophilie B, déficit partiel ou complet en FIX, touche environ 80 000 personnes à l’échelle mondiale et représente environ 20 % de tous les cas d’hémophilie. L’administration de FIX à titre prophylactique demeurant sous-utilisée, les patients atteints d’hémophilie B sont vulnérables aux hémorragies sévères pouvant mener à la mort ou à l’amputation d’un membre, sans compter qu’ils peuvent souffrir d’arthropathies découlant d’hémarthroses récurrentes. Les hémophiles chez qui la prophylaxie est amorcée après l’âge de 3 ans continuent d’avoir des hémorragies, quoique moins fréquentes. Selon des données épidémiologiques, certains patients développent des troubles articulaires.
On a aussi appliqué la technologie de fusion avec le Fc au rFIX afin d’en prolonger la demi-vie dans le traitement de l’hémophilie B. Au nombre des essais cliniques menés à ce jour sur le rFIX-Fc figurent un essai de phase I/IIa (Shapiro MD et al. Blood 2012;119:666-72) et l’essai de phase III B-LONG, dont les résultats ont été présentés par le Dr Jerry S. Powell, Hemophilia and Thrombosis Center, University of California (UC), Davis Comprehensive Cancer Center. «Cet essai international regroupait 123 patients déjà traités (âge médian : 30 ans) atteints d’hémophilie B sévère qui n’avaient pas d’antécédents d’inhibiteurs anti-FIX. Les patients ont été randomisés dans l’un des 4 groupes suivants : prophylaxie hebdomadaire (dose initiale de 50 UI/kg tous les 7 jours qui était ensuite ajustée de façon à maintenir le taux de FIX); prophylaxie à intervalles individualisés (100 UI/kg tous les 10 jours dans un premier temps, après quoi l’intervalle était ajusté de façon à maintenir le taux de FIX); traitement épisodique (à la demande) (20 à 100 UI/kg); ou prise en charge périopératoire. Selon des analyses PK réalisées à partir d’échantillons de sang prélevés pendant 96 heures chez 22 patients sous prophylaxie hebdomadaire par le rFIX-Fc à des fins de comparaison avec des patients sous rFIX, la demi-vie moyenne du rFIX-Fc se chiffrait à 82,1 h vs 33,8 h pour le rFIX. L’analyse des échantillons pendant les premières 48 heures a révélé que la demi-vie médiane (IC à 95 %) se chiffrait à 17,04 (15,89-18,26) heures pour BeneFIXMD, ce qui concorde avec la demi-vie moyenne de 18,1 ± 5,1 heures indiquée dans la monographie de produit. La PK du rFIX-Fc s’est révélée stable au fil des doses. L’intervalle moyen précédant le retour à un taux de FIX de 1 % après l’administration d’une dose de 50 UI/kg était de 11,2 jours pour le rFIX-Fc vs 5,1 jours pour le rFIX. La clairance s’est améliorée : 3,19 vs 6,34 mL/h/kg, respectivement. «Il importe ici de souligner que l’intervalle précédant le retour à un taux de FIX de 1 % était significativement plus long lorsque l’élimination était plus lente (médiane de 11,2 jours pour le rFIX-Fc vs 6,1 jours pour le rFIX), souligne le Dr Powell. Toutes ces différences étaient statistiquement significatives (p<0,001). «L’avènement de produits dotés d’une demi-vie prolongée nous permet de maintenir un taux de FIX associé à une activité supérieure à 1 % [1 UI/dL] chez nos patients – ce qui est pratique bien sûr, mais aussi fort prometteur», dit-il. L’intervalle inter-doses chez les sujets sous prophylaxie à intervalles individualisés est passé de 10 jours au départ à ≥14 jours chez 53,8 % des sujets au cours des 3 derniers mois de l’étude.
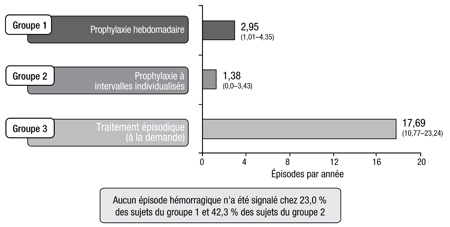
On a observé une diminution marquée du TAH chez les patients sous prophylaxie hebdomadaire et individualisée comparativement aux patients sous traitement épisodique (2,95 et 1,38, respectivement, vs 17,69) (Figure 2). Parmi les patients sous prophylaxie hebdomadaire (dose fixe) et sous prophylaxie individualisée – soit 23,0 % et 42,3 % des sujets, respectivement –, aucun épisode hémorragique n’a été signalé au cours des 12 mois de l’étude. «Le bénéfice associé au rFIX-Fc et à ses paramètres PK améliorés observé dans chaque sous-groupe n’a rien d’étonnant», fait remarquer le Dr Powell. Comme on pouvait s’y attendre, le TAH était plus élevé dans le groupe traité à la demande. «Le bénéfice associé au rFIX-Fc a été substantiel à la fois dans le groupe sous prophylaxie et le groupe traité à la demande avant l’étude. De même, le traitement a été bénéfique à la fois chez les sujets qui avaient eu très peu d’épisodes hémorragiques au cours de l’année précédant l’étude et ceux qui, au contraire, en avaient eu beaucoup.»
Figure 2. Paramètre principal : Taux annualisé d'hémorragies (TAH) par sujet
Il a été démontré dans l’essai B-LONG que le rFIX-Fc était sûr. Le profil d’EI était conforme aux attentes pour une population typique de patients atteints d’hémophilie B.
Au total, 636 épisodes hémorragiques ont été traités chez 89 sujets de l’essai B-LONG : il a suffi d’une injection de rFIX-Fc pour maîtriser 90,4 % des épisodes hémorragiques et ≤2 injections pour maîtriser 97,3 % des épisodes hémorragiques. «La maîtrise des épisodes hémorragiques était au moins comparable à ce que l’on obtient avec les produits actuels», affirme le Pr John Pasi, Barts and The London School of Medicine and Dentistry, Queen Mary, University of London, Royaume-Uni. La dose médiane par injection était de 46,1 UI/kg et la dose totale par épisodes hémorragique, de 47,0 UI/kg. L’autoévaluation de la réponse aux injections de rFIX-Fc a révélé que cette dernière était «excellente» ou «bonne» chez 82 % des sujets, alors que selon le point de vue des médecins (PGA), elle était «excellente» ou «efficace» chez 98,8 % des sujets. L’efficacité était constante dans tous les sous-groupes, et aucun sujet n’a eu de réponse qualifiée d’inefficace lors des consultations. Ces résultats s’ajoutent à ceux de l’analyse principale de l’efficacité de l’essai B-LONG pour établir que le rFIX-Fc est un traitement efficace, qu’il soit administré à titre prophylactique ou à la demande pour maîtriser les hémorragies», conclut-il.
Le Pr Uri Martinowich, Centre médical Chaim Sheba, Tel HaShomer, Israël, a pour sa part présenté des données d’un essai de phase I/II sur l’efficacité clinique du schéma hebdomadaire reposant sur la protéine de fusion FIX-albumine (rIX-FP; CSL654). Le rIX-FP fait l’objet d’un essai clinique intitulé PROLONG-9FP dont l’objectif est de l’évaluer pour une utilisation prophylactique et à la demande dans le traitement de l’hémophilie B. Lors de cet essai, 17 patients ont reçu le rIX-FP, 13 en prophylaxie hebdomadaire pendant 11 mois et 4 en traitement à la demande. Tous les patients sous traitement prophylactique ont poursuivi leur traitement durant toute l’étude, et le TAH moyen a atteint 1,26. Tous les épisodes hémorragiques ont été maîtrisés avec ≤2 perfusions, et il a suffi d’une seule perfusion pour traiter 95,3 % des hémorragies. Après une perfusion unique de 25 UI/kg de rIX-FP, l’activité moyenne du FIX était de 3,8 % et de 2,7 % aux 7e et 14e jours, respectivement, et la demi-vie était de 94 h. Pour obtenir une diminution significative du nombre d’hémorragies chez les patients atteints d’hémophilie B, il faut compter 2 ou 3 perfusions de FIX par semaine, explique le Pr Martinowich. «Cet essai a montré qu’il fallait moins de perfusions avec le rIX-FP qu’avec les produits de substitution du FIX actuels pour traiter les épisodes hémorragiques à la demande ou les prévenir», dit-il.
Prise en charge périopératoire
Le Dr Powell a également présenté des données sur l’efficacité hémostatique du rFIX-Fc chez 12 sujets de B-LONG qui ont subi 14 interventions chirurgicales majeures (arthroplasties pour la plupart). Chez ces patients, le rFIX-Fc a été associé à une hémostase périopératoire que les chercheurs/chirurgiens ont qualifiée d’«excellente» ou de «bonne» dans tous les cas. «L’hémostase obtenue après la perfusion du rFIX-Fc a semblé comparable à celle que l’on obtient lors d’interventions similaires pratiquées chez des patients non hémophiles», affirme le Dr Powell. Les pertes de sang de 65,5 mL (médiane) durant l’intervention chirurgicale et de 0 mL durant la période postopératoire s’apparentent à ce que l’on observerait lors de toute chirurgie majeure. Aucune transfusion n’a été nécessaire durant l’intervention, mais deux sujets ont dû être transfusés après l’intervention. Une injection de rFIX-Fc a suffi à maintenir l’hémostase durant l’intervention dans 85,7 % des chirurgies, et la dose médiane était de 90,9 UI/kg par injection. Dans la plupart des cas, il a fallu pratiquer 1 ou 2 injections la veille de la chirurgie et le jour même, et la plupart des sujets ont eu besoin de 2 ou 3 injections de
1 à 3 jours après l’intervention. Chez la plupart des patients, la dose quotidienne totale de rFIX-Fc était moindre entre les 4e et 14e jours suivant l’intervention. Dans l’ensemble, un ou plusieurs EI ont été signalés chez 10 (83,3 %) des 12 sujets, et 3 sujets ont signalé 6 EI graves, lesquels ont tous disparu et ont été considérés comme non liés au traitement par le rFIX-Fc. «Il s’agit là de résultats auxquels on pourrait s’attendre à l’occasion d’une intervention majeure chez des patients hémophiles», précise le Dr Powell. Aucun des sujets de l’étude n’a développé d’inhibiteurs, et aucun n’a eu de réaction anaphylactique ou de thrombose. «C’est un très bon exemple de l’utilisation future du rFIX-Fc – nous réaliserons des économies incroyables», ajoute-t-il, précisant que les chercheurs avaient réussi à surveiller l’activité du FIX chez les patients subissant une chirurgie majeure en ayant recours à des laboratoires locaux.
Modèle pharmacocinétique
Des chercheurs américains ont mis au point un modèle PK de population tricompartimental afin d’évaluer divers schémas posologiques de rFIX-Fc pour la prophylaxie, le traitement à la demande et la prise en charge périopératoire de patients atteints d’hémophilie B (Diao L et al. Hemophilia 2013;19[Suppl 2]:33. résumé PO040). Le modèle a été conçu à partir du profil PK de 12 sujets de l’essai de phase I/IIa
sur le rFIX-Fc (Shapiro M et al. MD et al. Blood 2012;119:666-72) ainsi que du profil PK initial de 123 sujets de l’essai B-LONG et des profils PK répétés de 21 sujets du même essai. En se servant de ce modèle pour simuler des schémas de prophylaxie chez des patients adultes, les chercheurs ont prédit que l’administration du rFIX-Fc à raison de 50 UI/kg 1 fois/semaine ou de 100 UI/kg tous les 10 à 14 jours permettrait de maintenir l’activité du FIX à ≥1 % chez la majorité des sujets. Des simulations de schémas de traitement à la demande ont pour leur part montré qu’une dose unique de 50 ou 100 UI/kg de rFIX-Fc serait suffisante pour générer une activité maximale du FIX de l’ordre de 40 à 80 UI/dL; c’est d’ailleurs ce que recommande la Fédération mondiale de l’hémophilie (Srivastava A et al. Haemophilia 2013;19:e1-47). Dans l’ensemble, la variabilité interindividuelle de la PK du rFIX-Fc était faible, et le poids corporel était la seule covariable faiblement liée à la PK du rFIX-Fc. «Compte tenu de l’ampleur de la marge thérapeutique des facteurs de substitution, l’administration d’une dose de rFIX-Fc qui serait indépendante du poids corporel (PK plate) serait, pour les adultes atteints d’hémophilie B, une approche viable qui mériterait d’être explorée plus à fond», affirme Mme Shuanglian Li, Ph.D., Biogen Idec. Le Dr Powell a expliqué comment on avait appliqué le modèle PK de population pour simuler l’activité du FIX chez les 12 sujets de l’essai B-LONG qui allaient être opérés et la comparer avec l’activité du FIX mesurée par les laboratoires central et locaux. L’activité du FIX mesurée durant la période périopératoire concordait en grande partie avec les prédictions fondées sur les caractéristiques PK des sujets avant la chirurgie, à savoir une faible utilisation de ce facteur durant ces interventions. C’est donc dire que l’activité observée du FIX était bien corrélée avec l’activité prédite; de l’avis du Dr Powell et de ses collaborateurs, ce modèle pourrait être utile pour guider la détermination des doses nécessaires à l’obtention de la forte activité plasmatique du FIX recommandée en période périopératoire chez les patients atteints d’hémophilie B. «Le rFIX-Fc est sûr et son effet est prévisible; toute personne qui a de l’expérience avec le rFIX saura s’adapter au rFIX-Fc», fait valoir le Dr Powell.
Glycopégylation
Il a été démontré que le rFIX glycopégylé N9-GP (nonacog bêta pegol) avait une demi-vie plasmatique significativement plus longue (93 h) que celle des préparations de rFIX actuellement sur le marché (Négrier C et al. Blood 2011;118:2695-701). Dans un essai de phase I, le N9-GP a également été associé à une clairance 10 fois plus lente, et la récupération progressive était presque deux fois plus élevée qu’avec le rFIX. Les résultats du premier essai de phase III sur le N9-GP – un essai multicentrique international mené à l’insu sur l’innocuité et l’efficacité – ont été présentés par le Dr Peter Collins, Arthur Bloom Haemophilia Centre, Cardiff University School of Medicine, Pays de Galles. L’essai visait à évaluer deux doses de N9-GP utilisées à titre prophylactique (10 et 40 U/kg), mais il comportait aussi un groupe de sujets recevant un traitement à la demande. Les résultats ont révélé que le N9-GP pouvait réguler la fréquence des épisodes hémorragiques en toute sécurité sans déclencher le développement d’inhibiteurs; l’efficacité prophylactique de la dose plus faible n’a toutefois pas pu être confirmée. L’essai regroupait 74 patients déjà traités (âge moyen : 31,4 ans) dont l’activité du FIX était ≤2 % et qui n’avaient pas d’antécédents d’inhibiteurs. Ils ont reçu du N9-GP à la demande (28 semaines) ou étaient randomisés à l’insu de façon à recevoir un schéma prophylactique de 10 U/kg ou de 40 U/kg de N9-GP 1 fois/semaine pendant 12 mois. Une dose unique de 40 U/kg (80 U/kg pour les hémorragies sévères) a suffi à traiter un épisode hémorragique dans tous les groupes. Une fois terminé le traitement, on a offert à tous les patients la possibilité de continuer de recevoir le N9-GP dans le cadre d’une prolongation. Aucune méthode n’a permis de déceler des inhibiteurs anti-FIX. Le dosage ELISA a toutefois permis de détecter un faible titre d’anticorps transitoires (non inhibiteurs) chez trois patients; chez deux de ces patients, les anticorps étaient déjà présents au départ et ont persisté tout au long de l’étude sans pour autant nuire aux propriétés PK ou à l’efficacité clinique de la molécule. Chez les patients randomisés de façon à recevoir 40 U/kg de N9-GP, 99 % des épisodes hémorragiques ont pu être traités au moyen d’une perfusion unique, et les hémorragies dans les articulations cibles ont pu se résorber complètement chez les deux tiers des patients. Parmi les 60 EI rapportés, 12 ont été considérés comme liés au traitement. Il n’y avait aucune différente apparente entre les groupes de traitement quant aux EI et aux paramètres standard d’évaluation de l’innocuité. Aucune thrombose ni réaction allergique n’a été signalée. Les résultats des analyses PK ont confirmé les données issues de l’essai de phase I sur le N9-GP, à savoir une demi-vie moyenne de 107,0 h et de 110,8 h associée aux doses de 10 et 40 U/kg, respectivement, à l’état d’équilibre et un taux minimum de FIX de 0,08 U/mL (10 U/kg) et de 0,31 (40 U/kg). Sur le plan de l’efficacité, les épisodes hémorragiques ont été maîtrisés chez 86,9 % des patients sous prophylaxie qui recevaient la dose de 10 U/kg et chez 97,1 % de ceux qui recevaient 40 U/kg, comparativement à un taux de succès de 95,1% chez les patients traités à la demande. Dans les groupes sous prophylaxie, le TAH prédéterminé a été atteint chez les patients qui recevaient la dose de 40 U/kg (2,5), mais pas chez ceux qui recevaient 10 U/kg (4,6). Le TAH médian s’établissait à 15,6 chez les patients traités à la demande, comparativement à 1,0 et à 2,9 pour les patients recevant à titre prophylactique 40 et 10 U/kg, respectivement. Il s’agit là d’un bon résultat, souligne le Dr Collins, car 98 % des patients ont été fidèles à leur traitement prophylactique. Parmi les patients qui avaient ≥1 articulation cible au départ, 10 des 15 sous prophylaxie à 40 U/kg, 1 des 13 sous prophylaxie à 10 U/kg et 2 des 12 traités à la demande n’ont eu aucune hémorragie durant le traitement.
Surveillance clinique
Pour tous les nouveaux agents utilisés dans le traitement de l’hémophilie, nous devons avoir des réactifs fiables pour la détermination du temps de céphaline activée (TCA) ainsi que des coagulomètres fiables qui permettent de surveiller l’activité du facteur cible. On a présenté une étude dans laquelle étaient comparés cinq réactifs du commerce d’usage répandu pour l’évaluation de l’activité du BAY 94-9027. Le BAY 94-9027 – rFVIII sans domaine B que l’on produit à l’aide de la même lignée cellulaire que celle utilisée pour le rFVIII-FS et qui est lié par covalence à une seule molécule de PEG – est un facteur expérimental qui, dans des modèles précliniques, a été associé à une activité prolongée en raison de sa demi-vie prolongée comparativement à un FVIII non pégylé (Mei B et al. Blood 2010 116:270-279). Lors d’un essai de phase I, sa demi-vie a été significativement (1,5 fois) plus longue et son ASC normalisée en fonction de la dose (ASC/D), significativement plus élevée que celles du rFVIII-FS (Coyle T et al. Haemophilia 2012;18[Suppl 3]:22. FP-MO-03.2-3). L’administration de doses répétées n’a pas modifié la demi-vie. Le BAY 94-9027 fait actuellement l’objet d’essais de phase II/III chez des adultes et des enfants. À ce jour, une perfusion unique a réussi à traiter efficacement cinq épisodes hémorragiques. On n’a détecté aucun anticorps – inhibiteur ou non – dirigé contre le FVIII ou tout autre composant du produit. Aux États-Unis, des chercheurs de Bayer HealthCare qui ont eu recours à des réactifs à base d’acide ellagique et à deux coagulomètres différents pour déterminer le TCA du plasma de patients atteints d’hémophilie A sévère ont constaté une forte corrélation entre tous les résultats, quels qu’aient été le réactif ou le coagulomètre, et ont ainsi conclu que ces réactifs étaient les mieux adaptés à l’évaluation de l’activité du BAY 94-9027 et à la surveillance, par un laboratoire d’hématologie, de l’activité procoagulante (FVIII:C) après la perfusion. Des réactifs à base de silice ont été associés à un temps de coagulation plus long et à une précision moindre, ce qui pourrait tenir à une interférence du groupe PEG avec l’activation de la phase contact sur la surface de la silice, de l’avis des chercheurs.
Du fait que la pégylation des protéines pourrait influer sur le temps de coagulation dans certains tests de détermination du TCA, des chercheurs de Diagnostica Stago ont évalué l’impact de la pégylation de deux facteurs, le N8-GP et le N9-GP (Novo Nordisk), sur l’activité du FVIII et du FIX, respectivement, en effectuant des analyses en une étape avec un vaste éventail de réactifs dans l’analyseur STA-R® (détection mécanique de caillots, Diagnostica Stago) ainsi que des épreuves chromogènes. Le N8-GP et le N9-GP – rFVIII et rFIX humains glycopégylés avec des molécules PEG de 40 kDa liées à des sites spécifiques – sont parvenus à un stade avancé du développement clinique pour le traitement de l’hémophilie A et B, respectivement (Tiede A et al. J Thromb Haemost 2013;11:670-8; Négrier C et al. Blood 2011;118:2695-701). Lorsque les chercheurs utilisaient comme étalons des molécules non pégylées (étalon international de l’OMS ou rFVIII), les taux de FVIII étaient sous-estimés si les réactifs utilisés étaient à base de silice alors qu’ils se situaient à l’intérieur des limites de la normale si les réactifs étaient à base de kaolin ou d’acide ellagique ou s’ils étaient mesurés par une épreuve chromogène. Lorsque la molécule N8-GP servait d’étalon, le taux de FVIII se situait toujours dans les limites de la normale, quel qu’ait été le réactif utilisé pour la détermination du TCA. Lorsqu’un étalon international de l’OMS ou un rFIX servait d’étalon, le taux de FIX était sous-estimé si le réactif était à base de kaolin, surestimé si le réactif était à base de silice et légèrement sous-estimé si le réactif était à base d’acide ellagique; il était toutefois à l’intérieur des limites de la normale si les chercheurs optaient pour une épreuve chromogène. Lorsque la molécule N9-GP servait d’étalon, le taux de FIX se situait toujours dans les limites de la normale, quel qu’ait été le réactif utilisé. L’étude a confirmé l’impact de la pégylation du FIX et du FVIII sur les épreuves de détermination du TCA visant à mesurer l’activité du FIX et du FVIII, respectivement, conclut la Dre Anne Lochu. Certains réactifs ont été associés à une activité normale lors de l’épreuve chromogène, alors que d’autres ont généré des résultats très variables. De l’avis de la Dre Lochu, la recherche doit se poursuivre pour que nous parvenions à comprendre les mécanismes biochimiques qui sous-tendent ces interactions et à normaliser les résultats de différentes façons, par exemple en utilisant un étalon particulier ou en attribuant un facteur de conversion à un test particulier afin d’obtenir des résultats comparables à ceux de l’épreuve chromogène.
Des chercheurs de Baxter BioScience ont discuté du développement d’un dosage de l’activité des préparations modifiées (MDAA, pour modification-dependent activity assay) permettant de mesurer sélectivement le rFVIII humain pégylé dans le plasma humain. L’épreuve MDAA repose à la fois sur l’utilisation d’un anticorps antiPEG et sur un test chromogène de mesure de l’activité du FVIII basé sur le facteur Xa. Ce test a été validé pour le BAX855 dans le plasma humain. Le BAX855 est un rFVIII pégylé que l’on a mis au point pour prolonger la demi-vie comparativement à celle du rFVIII sans plasma ni albumine (Turecek PL et al. Hämostaseologie 2012;32[Suppl 1]:S29-38). La spécificité de cette épreuve a permis de mesurer l’activité du BAX855 dans le plasma humain normal et le plasma dépourvu de FVIII sans interférence avec le FVIII endogène; l’erreur totale moyenne était de 17,7 % à la limite inférieure de quantification (LLOQ) de l’épreuve de 0,07 U/mL et de <15 % à d’autres concentrations de BAX855 explorées. De l’avis des chercheurs, ce concept particulier – c’est-à-dire la captation sélective du rFVIII pégylé avant la mesure de son activité – peut s’appliquer à d’autres protéines pégylées. Les résultats obtenus avec ce test récent permettront de déterminer si la protéine pégylée demeure intacte.
En général, les laboratoires d’hémostase clinique surveillent le taux de FIX en effectuant l’épreuve en une étape avec un réactif et un pool de plasma normal étalon conforme aux normes de l’OMS. Vu la variabilité significative des résultats d’un laboratoire à l’autre et des réactifs utilisés pour la détermination du TCA, on a réalisé une étude sur le terrain afin de mesurer l’exactitude des dosages de l’activité du FIX-Fc comparativement à celle des dosages de l’activité du rFIX dans des échantillons de plasma enrichis et de déterminer la variabilité inter-laboratoires au sein d’un groupe de 30 laboratoires d’hématologie clinique. L’évaluation à l’insu d’échantillons par l’analyse en une étape utilisant un étalon maison de plasma avec FIX a objectivé une surestimation considérable du taux de récupération de rFIX-Fc moyen (entre 121 % à 0,8 UI/mL et 167 % à 0,05 UI/mL). Le taux de récupération de rFIX-Fc médian se situait entre 88 % et 132 %. Parmi les réactifs utilisés pour la détermination du TCA, l’acide ellagique a été en général celui qui était associé à la plus forte activité observée et à une bonne corrélation entre le rFIX-Fc et le rFIX. En comparaison, la silice et le kaolin étaient typiquement associés à une récupération moindre de rFIX-Fc. Une forte variabilité inter-laboratoires a été observée, les coefficients de variation étant situés entre 13 % et 31 % pour le rFIX et entre 27 % et 45 % pour le rFIX-Fc.Les effets différentiels réactif-dépendants sur le rFIX-Fc et le rFIX observés sur le terrain ont été reproductibles dans une comparaison directe réalisée par un laboratoire central. Pour les deux produits, les résultats du test étaient généralement homogènes lorsque les laboratoires utilisaient les mêmes réactifs et les mêmes étalons; les épreuves à base de silice et de kaolin montraient un taux de récupération de rFIX-Fc moyen de 80 % et 60 % (le pire résultat), respectivement, alors que le taux de récupération de rFIX à la dose de 0,8 UI/mL se situait entre 80 % et 125 % du résultat théorique. Ces résultats indiquent en outre que l’uniformisation des méthodes et des réactifs – qui s’impose – permettra d’améliorer l’exactitude des dosages de l’activité des préparations actuelles de rFIX ainsi que de définir avec plus de précision et de prévoir l’impact éventuel des différences entre les dosages des préparations de rFIX modifiées.
Obstacles au traitement dans la pratique clinique
E. P. Armstrong, Pharm. D., Thérapeutiques stratégiques, LLC & College of Pharmacy, University of Arizona, Tucson, Arizona, a présenté une étude sur le traitement de l’hémophilie dans la pratique clinique. Cette étude a été réalisée à l’aide de dossiers médicaux électroniques et de données issues de consultations et de demandes de règlement que le Department of Defense (DOD) des États-Unis recueillait pour des militaires et leur famille. «Cette base de données était particulièrement avantageuse du fait qu’elle contenait des données accumulées sur plusieurs années pour les mêmes patients, ce qui est inhabituel aux États-Unis, les patients ayant tendance à changer souvent d’organisme de gestion des soins, explique le M. Armstrong. Nous cherchions à savoir comment les patients utilisaient réellement les produits antihémophiliques», dit-il, précisant que la non-adhésion aux schémas prescrits annihile les avantages de la prophylaxie (Thornburg CD. J Coagul Disord 2010;2:9-14). L’étude d’observation rétrospective – dont les données s’échelonnaient entre 2006 et 2011 – regroupait 207 patients hémophiles (74,9 % et 25,1 % de patients atteints d’hémophilie A et B, respectivement) qui avaient reçu des facteurs de coagulation au moins deux fois pendant la période étudiée. L’âge médian de ces patients était de 7,0 ans, la plupart étant des enfants dont au moins un parent travaillait pour le DOD. La base de données comptait 101 (48,8 %) patients atteints d’hémophilie légère, 32 (15,5 %) atteints d’hémophilie modérée et 74 (35,7 %) atteints d’hémophilie sévère. L’adhésion au traitement médicamenteux a été évaluée d’après les demandes de règlement pour les facteurs de coagulation prescrits durant un maximum de 10 périodes séquentielles de 180 jours continus pour chaque patient. Durant chaque période, on quantifiait l’adhésion en divisant la quantité totale de facteur de coagulation fournie au patient par 180 jours. Les patients étaient considérés comme observants au cours de cette période si le ratio quantité totale de facteur/jours d’observation était ≥60 %. On a enregistré un nombre significativement plus élevé de périodes où le taux d’adhésion était d’au moins 69 % chez les patients atteints d’hémophilie sévère, comparativement aux patients atteints d’hémophilie légère ou modérée, à en juger par le ratio quantité totale/jours d’observation (51% vs 14 % et 21 %, respectivement; p<0,001). «Nous nous attendions logiquement à une observance médiocre chez les patients atteints d’hémophilie légère ou modérée, car un grand nombre d’entre eux étaient traités à la demande», affirme M. Armstrong. Chez les patients atteints d’hémophilie sévère, par contre, l’adhésion était très variable, 66,2 % des patients ayant été observants moins de 70 % du temps (Figure 3).
Figure 3. Adhésion au traitement par un facteur de coagulation chez des sujets atteints d'hémophilie A ou B
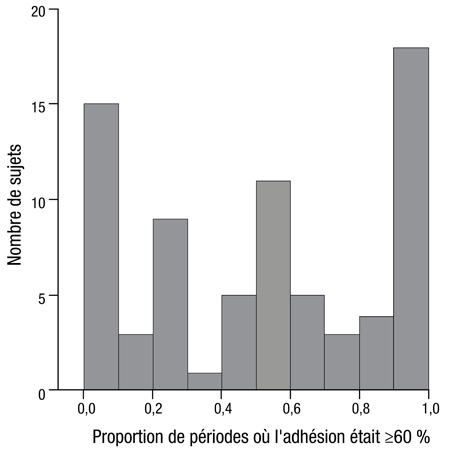
«Ces résultats nous ont étonnés, car un certain nombre d’études publiées qui avaient été réalisées à partir de registres avaient fait ressortir des pourcentages plus élevés, reconnaît M. Armstrong. En conditions réelles, nous avons constaté que parmi les patients atteints d’hémophilie sévère – qui, penserait-on, recevraient un traitement prophylactique –, nombreux étaient ceux qui n’adhéraient pas à leur traitement. Les sujets les plus observants recevaient une grande quantité de facteur de coagulation, comme nous nous y attendions, ajoute-t-il. Nous avons par contre été surpris de constater le nombre élevé de sujets hémophiles qui n’en recevaient pas beaucoup; cette observation importante était systématique.» M. Armstrong insiste sur le fait que la faible adhésion ne tenait pas à des difficultés financières, puisque tous les patients recevaient leurs médicaments gratuitement. De plus, encore là contre toute attente, les taux d’adhésion chez les enfants n’étaient pas aussi élevés que nous l’aurions imaginé vu l’encadrement parental. «Nous pensions que de nombreuses personnes recevraient un traitement prophylactique ou à la demande, mais nos résultats montrent que ce n’est pas le cas. Cette mise en évidence de très faibles taux d’adhésion pourrait avoir d’importantes retombées cliniques, dit-il, car l’adhésion contribue très étroitement à la prévention des lésions articulaires.» De l’avis de M. Armstrong, la collaboration avec l’équipe soignante et l’utilisation de produits plus faciles à administrer pourraient avoir des retombées positives.
Résumé
Depuis 20 ans, le traitement de l’hémophilie repose sur l’utilisation de facteurs de coagulation recombinants, lesquels ont considérablement augmenté les possibilités de traitement de substitution à l’échelle mondiale et de prophylaxie énergique. De nombreux aspects du traitement font obstacle à la généralisation de la prophylaxie, mais des préparations innovantes de facteurs de coagulation pour le traitement des hémophilies A et B devraient permettre de corriger le tir. De plus, comme on l’a dit au congrès de l’ISTH et lors d’autres congrès récents sur l’hémophilie, des préparations de rFVIII et de rFIX à longue durée d’action qui nécessitent moins d’injections seront probablement homologuées bientôt dans un certain nombre de pays. On espère que ces produits allégeront le fardeau du traitement pour les patients et, partant, que la prophylaxie se généralisera et que les résultats cliniques s’amélioreront. Entretemps, la poursuite de la recherche sur la thérapie génique demeure sans doute la clé de la guérison de l’hémophilie.