Comptes rendus
De nouveaux éléments d’information sur le traitement du syndrome hémolytique et urémique atypique
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PRESSE PRIORITAIRE - Assemblée générale annuelle de la Société canadienne de néphrologie
Montréal, Québec / 24-28 avril 2013
Montréal - Le syndrome hémolytique et urémique atypique (SHUa), affection rare causée par des anomalies génétiques ou acquises dans le système du complément, se caractérise par une atteinte progressive et potentiellement mortelle des reins, de la circulation et du système nerveux central. Les échanges ou perfusions plasmatiques peuvent être efficaces, mais l’obtention d’une réponse clinique n’est pas garantie et les effets indésirables sont assez fréquents. Des études présentées au congrès ont montré que l’éculizumab, un anticorps monoclonal, atténuait efficacement les signes hématologiques et cliniques du SHUa et améliorait la qualité de vie tout en étant sûr. Des conférenciers ont aussi confirmé la nécessité d’une exploration plus poussée des causes et des mécanismes du SHUa.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
Le syndrome hémolytique et urémique atypique (SHUa) est une affection rare ayant souvent pour cause une ou plusieurs anomalies génétiques dans le système du complément du système immunitaire. Le SHUa résulte de la dérégulation de la voie alterne du complément. L’activation incontrôlée et chronique de la cascade du complément donne lieu à une activation plaquettaire, à des thromboses, à une hémolyse et à une microangiopathie thrombotique (MAT), ce qui a pour effet une atteinte progressive et potentiellement mortelle des reins, de la circulation, de l’appareil digestif et du système nerveux central (SNC). Au nombre des autres MAT figurent le SHU à Escherichia coli producteur de shigatoxines (SHU-STEC) et la thrombocytopénie thrombotique, lesquels devraient être pris en compte dans le diagnostic différentiel.
«L’issue clinique d’un SHUa est mauvaise. L’atteinte rénale finit par devenir terminale chez un certain nombre de patients [généralement en l’espace de 3 ans], et notre objectif doit être de sauver la fonction rénale à l’aide d’un traitement approprié», fait valoir le Dr Martin Bitzan, directeur de la néphrologie pédiatrique, Hôpital de Montréal pour enfants, Québec. Moins de 1 an après le diagnostic, plus de 50 % des patients atteints d’un SHUa doivent être dialysés, ont une atteinte rénale irréversible ou meurent.
Bien qu’il soit souvent défini comme une hémopathie qui frappe le rein, le SHUa a en fait des ramifications beaucoup plus étendues, affirme le Dr Christoph Licht, professeur agrégé de pédiatrie et néphrologue, Hospital for Sick Children, Toronto, Ontario. «Par le passé, nous avons sous-estimé la nature systémique de la maladie. Ce n’est qu’au cours des dernières années que nous nous sommes rendu compte de l’existence de manifestations extrarénales touchant le SNC et la quasi-totalité des autres systèmes organiques.»
Déficits dans le système du complément
Lorsqu’on suspecte un SHUa, il est idéal de pouvoir confirmer le diagnostic après avoir repéré la cause, mais il n’est pas toujours possible de cerner une mutation particulière. Environ le tiers des patients atteints d’un SHUa sont porteurs d’une mutation ou d’anticorps touchant le facteur H du système du complément, explique le Dr Bitzan. Un déficit en facteur I ou en MCP (membrane cofactor protein) et en d’autres protéines régulatrices ou activatrices du complément pourrait aussi être en cause. «À l’heure actuelle, à l’aide de méthodes diagnostiques optimales, il est possible de confirmer la régulation anormale des inhibiteurs du complément chez 50 à 60 % des patients atteints d’un SHUa», ajoute-t-il.
Options de traitement
Le traitement du SHUa repose généralement sur les échanges/perfusions plasmatiques (EP/PP), indique le Dr Bitzan. La plasmathérapie peut toutefois poser des problèmes techniques et, surtout chez les enfants, elle peut entraîner des effets indésirables comme des réactions allergiques, la formation de caillots, des hémorragies ou des infections virales après un traitement énergique ou une exposition à long terme. «Nous sommes en train d’évaluer tous les patients qui étaient en traitement [...], et nous constatons beaucoup de problèmes liés au cathéter, de thromboses et d’infections. De plus, les [EP] viennent perturber la vie des enfants qui ont besoin d’un traitement au long cours», fait remarquer le Dr Bitzan. De plus, la réponse clinique aux EP/PP n’est pas homogène. «Chez certains patients, elle est de courte durée alors que chez d’autres, elle est durable; d’autres encore n’y répondent jamais», précise le Dr Licht.
Santé Canada a homologué l’éculizumab, anticorps monoclonal humanisé, pour le traitement du SHUa. L’éculizumab se lie à la protéine C5 du complément, bloquant ainsi la production de protéines pro-inflammatoires (C5a et complexe C5b-9). De cette façon, il inhibe la voie terminale du système du complément, y compris la formation du complexe d’attaque membranaire.
Cet agent, qui traite efficacement le SHUa, semble éviter les problèmes d’innocuité et de tolérabilité associés à la plasmathérapie, affirme le Dr Licht. «Que nous sachions, ce médicament a peu d’effets indésirables et semble très efficace. De plus, c’est vraiment une percée pour les patients atteints d’une maladie dépendante du complément, surtout le SHUa.» À ce jour, les données cliniques ont été recueillies principalement chez des adolescents et des adultes. «Nous n’avons pas beaucoup d’expérience chez les enfants de moins de 12 ans traités sur une longue période», déplore-t-il.
Les premières études ont montré que l’éculizumab inhibait le processus systématique et progressif qui sous-tend la MAT, ce qui prévient et peut même faire régresser l’atteinte organique. Après 1 an de traitement, chez 95 % des patients sous éculizumab, on n’avait observé aucun événement clinique lié à la MAT et le débit de filtration glomérulaire (DFG) avait augmenté de 30 %. Le traitement a également amélioré la qualité de vie des patients.
Données à deux ans
Dans le cadre de prolongations d’études ouvertes à groupe unique présentées au congrès, le Dr Licht et ses collaborateurs se sont penchés sur l’efficacité et l’innocuité du traitement par l’éculizumab qui s’était poursuivi pendant 2 ans chez des patients atteints d’un SHUa. Dans une étude (affiche 115) à laquelle étaient inscrits 17 patients dont la maladie durait depuis 9,7 mois (médiane), les chercheurs ont observé une atteinte rénale et une progression de la MAT malgré des EP/PP chroniques. Chaque patient a reçu 900 mg/semaine d’éculizumab pendant 4 semaines, puis 1200 mg/semaine pendant 1 semaine et, par la suite, 1200 mg toutes les 2 semaines.
Parmi les patients dont la numération plaquettaire était faible au départ, 87 % avaient des valeurs normales à 26 semaines, et ces valeurs sont demeurées normales pendant 2 ans chez la majorité (12/13). Le bilan hématologique s’était normalisé chez 76 % des patients à 26 semaines et chez 85 % des patients à 1 an, et il était toujours normal à 2 ans. La MAT avait disparu (12 semaines consécutives sans chute de la numération plaquettaire >25 % par rapport à la numération initiale ni nouvelle plasmathérapie ou séance de dialyse) et l’absence de MAT se maintenait à 2 ans chez 88 % des sujets de l’étude. Les chercheurs ont aussi observé des améliorations du DFG estimé (DFGe) et de la fonction rénale.
Dans le deuxième essai (affiche 116), à 26 semaines, le bilan hématologique s’était normalisé chez 90 % des 20 patients atteints d’un SHUa (ancienneté médiane de 48 mois) qui présentaient une insuffisance rénale chronique connexe, et la MAT avait disparu chez 80 % des patients. À 2 ans, les pourcentages correspondants s’élevaient respectivement à 90 % et à 95 %. Le traitement continu par l’éculizumab a aussi donné lieu à une amélioration progressive du DFGe, du stade de la maladie rénale chronique, de la créatininémie et de la protéinurie au fil de l’étude (Tableau 1).
Tableau 1. Variation de la fonction rénale chez les patients porteurs d’un SHUa avec MAT évolutive
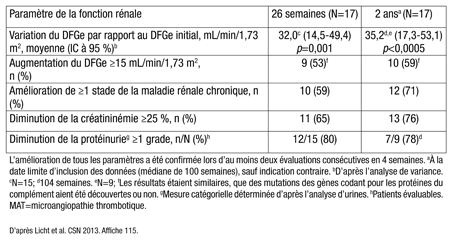
Dans les deux essais, la voie terminale du complément était déjà inhibée 1 heure après la perfusion et l’inhibition se maintenait toujours à 2 ans. L’effet de l’éculizumab était semblable chez les patients porteurs de diverses mutations de gènes codant pour les protéines du complément. Le médicament a été considéré comme sûr et bien toléré; le taux d’effets indésirables est demeuré stable ou diminuait à mesure que l’étude progressait.
Les patients recevant un traitement au long cours par l’éculizumab ont fait état d’une amélioration de la qualité de vie, selon le score EQ-50. Le changement a été plus frappant que prévu, ajoute le Dr Licht. «Même chez les patients qui ne présentent pas de symptômes extrarénaux très évidents, on observe un problème que l’on pourrait qualifier de fatigue chronique [...] Or, nombreux sont les patients qui éprouvent un regain d’énergie immédiat dès qu’ils reçoivent ce médicament. Et, à mon sens, c’est là un solide argument à l’appui de la nature systémique de la maladie et de l’efficacité de ce traitement.»
La recherche se poursuit
Nous espérons que les prochaines études sur l’éculizumab nous aideront à élucider certaines questions cliniques encore sans réponse, comme la posologie optimale, affirme le Dr Licht. «Une dose moindre serait-elle tout aussi efficace? Ou, à l’autre extrême, comme les symptômes réapparaissent pendant le traitement chez certains patients qui reçoivent la dose actuelle [...], quand doit-on [augmenter] la dose pour prévenir ces accès de la maladie?»
Selon ce que l’on sait actuellement du SHUa, un traitement à vie s’impose. «La cause sous-jacente de cette maladie, qu’elle soit génétique ou auto-immune, ne disparaît pas. Au fond, on ne fait que composer efficacement avec les conséquences de la maladie. Le traitement continu se justifie donc sans problème», fait valoir le Dr Licht. Cela dit, la découverte de certains génotypes ou phénotypes pourrait générer un spectre de risque qui dicterait l’intensité du traitement.
Les causes et les mécanismes du SHUa doivent aussi être approfondis, souligne le Dr Licht. «Nous [devons] pousser notre examen des aspects génétiques de la maladie et comprendre ce qui se passe au niveau moléculaire.»