Comptes rendus
Les données le prouvent : la malnutrition est un grave problème justifiant une intervention nutritionnelle précoce
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
INFO-RESSOURCES - Nutrition
Décembre 2011
Il ressort de données publiées qu’une intervention nutritionnelle appropriée – l’un des piliers de la prise en charge des maladies – peut améliorer l’issue clinique et, dans bien des cas, abaisser le coût des soins. L’évaluation précoce et systématique de l’état nutritionnel permet de prévenir la malnutrition, voire de la faire régresser, et constitue un bon point de départ pour le suivi et le traitement de toute aggravation subséquente de l’état nutritionnel. Chez les patients hospitalisés et les malades chroniques, le dépistage systématique de la malnutrition protéino-énergétique (MPE), source d’une morbi-mortalité évitable, fait défaut. La MPE est une forme distinctive de malnutrition qui se caractérise par la perte de réserves protéiques essentielles au rétablissement. Chez les personnes vivant à domicile, surtout les personnes âgées, la MPE contribue largement à la fragilité et accélère la détérioration de l’état de santé. Le dépistage de la MPE a donc sa raison d’être dans divers contextes, y compris dans les établissements de soins de courte et de longue durée. La science de la détection et de la prise en charge de la malnutrition doit maintenant être mise en pratique.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
Malnutrition et perte de masse maigre
On parle de malnutrition – parfois non liée à l’apport calorique total – lorsque l’apport insuffisant de nutriments altère la physiologie normale. Au sens large, le terme «malnutrition» englobe toutes les formes de nutrition inappropriée, y compris la dénutrition et la surnutrition. En l’absence d’un apport nutritionnel suffisant pour la synthèse protéique, les besoins tissulaires et organiques en acides aminés entraînent l’épuisement des réserves endogènes de protéines; si, à cet apport insuffisant s’ajoute une grave maladie chronique, on observera alors une diminution de la masse musculaire et la mise en branle d’un processus pouvant mener à la cachexie, à la faiblesse et à la fonte du corps.
Dans les pays industrialisés comme le Canada, les complications de la malnutrition chez les patients atteints de maladies chroniques résultent principalement d’une perte de masse maigre (MM). La MM – qui constitue environ 75 % du poids corporel – désigne tous les tissus, tels les muscles et les os, à l’exclusion de la graisse. La perte de masse musculaire qui s’observe avec le vieillissement – ou sarcopénie1 – commence vers la quarantaine et s’accélère vers l’âge de 60 ans2.
Les patients malnutris présentent des carences en nutriments essentiels au fonctionnement de certains organes. Le métabolisme des protéines, par exemple, est essentiel à la cicatrisation. La malnutrition protéino-énergétique (MPE) s’installe lorsque des anomalies métaboliques diminuent la synthèse des protéines par rapport à leur dégradation physiologique, créant ainsi un déséquilibre. La MPE entraîne la perte de MM, y compris de muscles squelettiques, et peut donc causer une sarcopénie.
Dans un contexte de soins de santé, il importe de reconnaître qu’aux premiers stades, la malnutrition ne se reflète pas forcément dans l’apparence du patient. Un faible indice de masse corporelle (IMC) – marqueur pas très sensible de la masse musculaire squelettique – est associé à un risque accru de mortalité chez les patients âgés3. Le risque augmente abruptement lorsque l’IMC chute à ≤21 kg/m2. Dans le cadre d’une étude multinationale qui regroupait plus de 5000 adultes hospitalisés de tous âges, le taux de mortalité a atteint 12 % chez les sujets qui présentaient un déficit nutritionnel au moment de la présélection vs 1 % chez les sujets qui n’en présentaient pas (p<0,001)4. Un faible poids corporel est aussi un prédicteur indépendant de risque accru de mortalité chez les patients vivant en centre d’hébergement et de soins de longue durée5, mais si on ne tente pas de dépister la malnutrition indépendamment d’un faible poids corporel, le diagnostic de malnutrition risque de passer inaperçu.
Un apport nutritionnel équilibré qui répond aux besoins individuels permet au patient de refaire le plein en nutriments essentiels, notamment en protéines et en vitamines. En fait, la protection et le rétablissement de la MM font partie des plus grandes priorités cliniques chez les malades chroniques qui présentent une MPE.
Taux de malnutrition et implications cliniques
Un apport insuffisant en nutriments peut certes contribuer à la MPE, mais comme le stress et les besoins métaboliques accrus découlant de certaines maladies varient, certains états pathologiques sont associés plus étroitement à la MPE que d’autres. Dans le cadre d’une étude globale sur son importance pronostique, la malnutrition liée à la maladie a été associée à une augmentation de la mortalité et de la morbidité, tant aiguë que chronique, à une prolongation de l’hospitalisation de même qu’à une augmentation des coûts de traitement6. Il ressort de certaines études, par exemple, qu’environ 25 % des patients hospitalisés présentent une MPE ou sont à risque de MPE7; le taux semble beaucoup plus élevé parmi les patients cancéreux, au point d’excéder 50 % dans certains cancers8. La maladie pulmonaire obstructive chronique (MPOC), l’insuffisance cardiaque et les maladies digestives figurent aussi parmi les pathologies qui exposent le patient à un risque élevé de MPE9-12. Sur une période de 6 mois, parmi des patients atteints de MPOC, le taux de mortalité était presque 3 fois plus élevé chez ceux qui étaient à risque de malnutrition que chez ceux qui ne l’étaient pas (16,3 % vs 5,5 %; p=0,023)13. Chez les patients atteints d’une maladie digestive, la malnutrition est associée à une diminution de la fonction musculaire et de la qualité de vie14. Les patients ayant des antécédents de troubles digestifs et ayant subi une intervention chirurgicale digestive constituent un important groupe de patients à risque de malnutrition.
Parmi les patients âgés, le taux de mortalité était trois fois plus élevé chez ceux qui présentaient une malnutrition liée à la maladie15. Même en l’absence de maladie chronique, les sujets âgés sont exposés à un risque élevé de malnutrition, et le taux de MPE augmente, peu importe les maladies dont ils souffrent. L’ampleur de la perte de masse musculaire squelettique semble multifactorielle, mais on estime que près du tiers des patients qui avancent en âge pourraient devenir cachectiques avant de mourir16. Les taux sont élevés non seulement chez les sujets âgés hospitalisés dans un établissement de soins de courte durée17, mais aussi chez les sujets âgés vivant en établissement de soins de longue durée, en foyer d’accueil et à domicile18. De multiples facteurs sont en cause, notamment une perte d’appétit et une mobilité moindre pouvant restreindre la capacité d’acheter de la nourriture et de préparer des repas, et le vieillissement de la population ne cesse d’amplifier ce problème de santé publique.
Vu le rôle fondamental de la MM dans la quasi-totalité des processus physiologiques, la perte de MM est également associée à un large éventail d’affections. De nombreuses données expérimentales et cliniques ont objectivé un lien entre la MPE et les anomalies de la cicatrisation des plaies19, ce qui pourrait avoir des retombées sur les plaies de décubitus, le risque d’infection et la durée du séjour à l’hôpital. On a constaté que les infections nosocomiales étaient environ trois fois plus fréquentes chez les patients hospitalisés malnutris que chez les patients non malnutris20. Ces problèmes cliniques sont indépendants d’une force musculaire diminuée, laquelle peut nuire à la capacité fonctionnelle21 – y compris la capacité de prendre soin de soi –, augmenter le risque d’accident22 et diminuer la qualité de vie, en partie à cause de la perte d’autonomie23.
Intervention d’efficacité démontrée
Le diagnostic et le traitement de la MPE chez les patients souffrant d’une maladie aiguë ou chronique devraient être aussi rigoureux et systématiques que ceux de problèmes concomitants contribuant à une piètre issue clinique. Considérer qu’il est moins important de corriger les déficits nutritionnels que de maîtriser la maladie, c’est faire fi du rôle clé de la malnutrition dans le processus morbide sous-jacent. Comme les suppléments nutritionnels oraux (SNO) peuvent faire reculer le risque d’épuisement des réserves protéinoénergétiques et améliorer l’issue clinique, ils ont probablement leur raison d’être chez de nombreux patients aux prises avec une MPE.
La baisse de mortalité est la meilleure preuve qui soit de l’existence d’un bénéfice clinique. À ce chapitre, beaucoup d’études associent les SNO à de meilleurs résultats. Une métaanalyse regroupant une vingtaine d’essais comparatifs avec randomisation sur les SNO – préparée pour le National Institute for Health and Clinical Excellence (NICE) au Royaume-Uni en prévision de ses recommandations nutritionnelles – a démontré que le risque relatif de décès avait diminué de 18 % (HR 0,82; IC à 95 % : 0,68-0,98; p<0,01) chez les sujets sous traitement actif par rapport aux témoins24. Selon une autre méta-analyse qui regroupait 11 études, la réduction du risque relatif a atteint 39 % (HR 0,61; IC à 95 % : 0,48-0,78; p<0,001)25. Enfin, selon une troisième méta-analyse qui portait sur 21 essais dont les sujets étaient tous malnutris au départ, le risque relatif de mortalité a diminué de 28 % (HR 0,72; IC à 95 % : 0,55-0,94; p<0,01)26. Les essais n’ont pas tous fait ressortir de réduction statistiquement significative, peut-être à cause de l’hétérogénéité des SNO et des populations à l’étude, mais la majeure partie des données font état d’une diminution mesurable de la mortalité au sein de diverses populations de malades chroniques.
Au chapitre de l’amélioration de l’état de santé, la réduction du risque de réhospitalisation est aussi considérée comme un puissant indicateur. Lors d’une étude menée à double insu avec randomisation qui regroupait 445 patients hospitalisés pour de nombreux motifs, la diminution de la durée de l’hospitalisation et de la mortalité chez les patients recevant des SNO, par rapport aux patients recevant des soins usuels, n’a pas atteint le seuil de significativité statistique. Par contre, la réduction du taux de réhospitalisation dans un délai de 6 mois était statistiquement significative (29 % vs 40 %; p<0,05)27 (Figure 1). Dans le cadre d’une deuxième étude avec randomisation lors de laquelle des SNO ont été associés à une amélioration de marqueurs de la capacité fonctionnelle, comme la force de préhension, et à une amélioration de la qualité de vie, le taux de réhospitalisation a diminué de 50 % sur une période de 3 mois (p=0,041)12. De nombreux autres résultats, notamment une diminution du taux global de complications et du taux de plaies de décubitus en particulier26,28,29, ont été associés à la prise de SNO par rapport à une autre forme de prise en charge, souvent des soins usuels sans suppléments nutritionnels.
Figure 1. Patients sous SNO vs sous traitement standard : taux de réhospitalisation
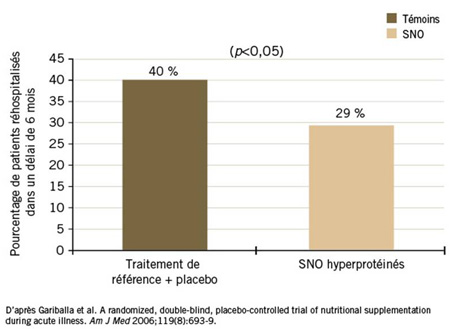
Les analyses de coûts réalisées dans le cadre des études sur les SNO plaident aussi en faveur d’une telle intervention. Par exemple, du fait qu’ils préviennent les plaies de décubitus, les SNO sont associés à une diminution des coûts générés par les plaies sévères (stade ≥III). Dans une perspective plus large, la baisse des coûts associée aux SNO – par comparaison à l’absence de suppléments nutritionnels – a été estimée d’après des projections et des économies réelles découlant d’une diminution de la durée d’hospitalisation30,31. De telles économies dépendent fortement des critères de sélection des patients, mais on a observé une diminution des coûts lorsqu’on avait recours à des SNO chez des patients âgés à risque élevé vivant à domicile pour prévenir leur hospitalisation et diminuer leur utilisation des ressources du système de santé32. Même lorsque l’amélioration de la qualité de vie était calculée à partir du nombre d’années de vie sans invalidité (QALY), les SNO se sont révélés efficients selon des données normatives dans un essai comparatif ciblant des patients atteints d’une maladie digestive bénigne33.
Considérations pratiques
Il est impossible de prévenir les conséquences de la MPE si l’on ne repère pas d’abord les sujets à risque. Les données actuelles montrant que le traitement de la malnutrition à l’aide de SNO réduit les risques pour la santé, y compris la mort, constituent une solide plateforme pour l’élaboration de méthodes diagnostiques systématiques. Dans le cadre d’une étude européenne, environ 40 % des hôpitaux sondés n’avaient pas de programme d’évaluation systématique de l’état nutritionnel à l’admission ou durant le suivi subséquent34. Au Canada, aucune enquête auprès des hôpitaux n’a encore été publiée, mais il est bien connu que de tels programmes n’existent pas dans tous les hôpitaux. Il existe des programmes efficaces d’évaluation de l’état nutritionnel, mais un protocole doit être appliqué uniformément si l’on aspire à de meilleurs soins cliniques.
Au nombre des outils de dépistage utiles de la malnutrition, on compte le NRS 2002 (Nutritional Risk Screening) et le MUST (Malnutrition Universal Screening Tool). Le MUST permet de calculer le risque associé aux maladies sous-jacentes et à des facteurs tels qu’une perte de poids récente et l’IMC initial35. Le NRS 2002 contient les éléments nutritionnels du MUST et, en outre, il permet de coter la sévérité de la maladie, celleci reflétant des besoins nutritionnels acccrus36. Il existe d’autres outils de dépistage, mais l’objectif est toujours le même : évaluer l’état nutritionnel systématiquement dans le cadre de l’évaluation clinique initiale et se doter de stratégies pour la réévaluation au fil du suivi. De telles stratégies sont appropriées non seulement dans un contexte de soins de courte durée, mais aussi dans un contexte de soins de longue durée, voire en ambulatoire, surtout chez les sujets âgés, dont le risque de malnutrition est très élevé. Les interventions nutritionnelles peuvent être adaptées aux résultats de l’évaluation.
Chez les patients qui répondent aux critères de la MPE, la prise de suppléments nutritionnels est la première mesure à envisager. Chez les patients capables de manger, les SNO utilisés seuls – ou plus souvent, combinés aux repas – peuvent offrir un apport équilibré de protéines et d’autres nutriments que l’alimentation usuelle fournit plus difficilement. Les SNO éliminent aussi le risque substantiel de non-adhésion au régime alimentaire prescrit chez les sujets ayant peu d’appétit.
Les divers SNO commercialisés diffèrent et ne sont probablement pas interchangeables. On trouve sur le marché, entre autres, des préparations novatrices qui fournissent à la fois des protéines, des vitamines et des minéraux, contribuant ainsi à rétablir l’équilibre dans le métabolisme des protéines.
Une approche nutritionnelle globale s’impose en raison de l’interdépendance des systèmes digestif et métabolique. Par exemple, certains produits se distinguent par l’ajout de fructooligosaccharides à chaîne courte afin de nourrir la flore intestinale résidente. Cet ajout contribue au rôle crucial de la fonction digestive au chapitre de l’absorption des nutriments et en maximise le bénéfice.
Dans de nombreux hôpitaux ainsi que dans d’autres contextes, le plus grand obstacle à un diagnostic et à une prise en charge efficaces de la MPE est l’absence d’un membre de l’équipe soignante pour défendre la cause et s’attaquer au problème. Les diététistes sont souvent disponibles pour des consultations, mais une approche systématique s’impose pour l’ensemble des patients. Une telle initiative devrait relever de personnes responsables des soins cliniques quotidiens, tels les médecins ou les membres du personnel infirmier. L’élaboration de programmes où la responsabilité du dépistage de la malnutrition serait clairement attribuée devrait avoir d’importantes retombées positives et, surtout, améliorer l’issue clinique pour le patient.
Résumé
La malnutrition est associée à de piètres résultats depuis longtemps déjà, mais de plus en plus de données lient l’évaluation de l’état nutritionnel et les interventions nutritionnelles à d’importants bénéfices cliniques, notamment à une diminution de la morbidité et de la mortalité. D’autres données montrent que le traitement de la malnutrition, notamment par l’utilisation de SNO, peut également réduire le risque d’une piètre issue clinique. Du point de vue du système de santé, une démarche systématique pour le traitement de la malnutrition pourrait réduire les coûts. Du point de vue des patients et des soignants, le dépistage et le traitement de la malnutrition représentent une stratégie d’efficacité démontrée.
Références
1. Wolfe RR. The underappreciated role of muscle in health and disease. Am J Clin Nutr 2006;84(3):475-82.
2. Janssen et al. Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol 2000;89(1):81-8.
3. Cereda et al. Body mass index and mortality in institutionalized elderly. J Am Med Dir Assoc 2011;12(3):174-8.
4. Sorensen et al. EuroOOPS: an international, multicentre study to implement nutritional risk screening and evaluate clinical outcome.
Clin Nutr 2008;27(3):340-9.
5. Lammes E, Akner G. Repeated assessment of energy and nutrient intake in 52 nursing home residents. J Nutr Health Aging 2006;10(3):222-30.
6. Norman et al. Prognostic impact of disease-related malnutrition. Clin Nutr 2008;27(1):5-15.
7. Kruizenga et al. Screening of nutritional status in The Netherlands. Clin Nutr 2003;22(2):147-52.
8. Argiles JM. Cancer-associated malnutrition. Eur J Oncol Nurs 2005;9 (Suppl 2):S39-S50.
9. Engelen et al. Nutritional depletion in relation to respiratory and peripheral skeletal muscle function in out-patients with COPD. Eur Respir J 1994;7(10):1793-7.
10. Mijan-de-la-Torre A. Recent insights on chronic heart failure, cachexia and nutrition. Curr Opin Clin Nutr Metab Care 2009;12(3):251-7.
11. Pablo AM, Izaga MA, Alday LA. Assessment of nutritional status on hospital admission: nutritional scores. Eur J Clin Nutr 2003;57(7):824-31.
12. Norman et al. Three month intervention with protein and energy rich supplements improve muscle function and quality of life in malnourished patients with non-neoplastic gastrointestinal disease—a randomized controlled trial. Clin Nutr 2008;27(1):48-56.
13. Collins et al. The impact of malnutrition on hospitalization and mortality in outpatients with chronic obstructive pulmonary disease. Proc Nutr Soc 2010;69:E148 (Abstract).
14. Norman et al. Malnutrition affects quality of life in gastroenterology patients. World J Gastroenterol 2006;12(21):3380-5.
15. Stratton et al. ‘Malnutrition Universal Screening Tool’ predicts mortality and length of hospital stay in acutely ill elderly. Br J Nutr 2006;95(2):325-30.
16. Morley JE, Anker SD, Evans WJ. Cachexia and aging: an update based on the Fourth International Cachexia Meeting. J Nutr Health Aging 2009;13(1):47-55.
17. Cansado P, Ravasco P, Camilo M. A longitudinal study of hospital undernutrition in the elderly: comparison of four validated methods. J Nutr Health Aging 2009;13(2):159-64.
18. Kaiser et al. Frequency of malnutrition in older adults: a multinational perspective using the mini nutritional assessment. J Am Geriatr Soc 2010;58(9):1734-8.
19. Demling RH. Nutrition, anabolism, and the wound healing process: an overview. Eplasty 2009;9:e9.
20. Schneider et al. Malnutrition is an independent factor associated with nosocomial infections. Br J Nutr 2004;92(1):105-11.
21. Humphreys et al. Muscle strength as a predictor of loss of functional status in hospitalized patients. Nutrition 2002;18(7-8):616-20.
22. Pizzigalli et al. Prevention of falling risk in elderly people: the relevance of muscular strength and symmetry of lower limbs in postural stability. J Strength Cond Res 2011;25(2):567-74.
23. Vetta et al. The impact of malnutrition on the quality of life in the elderly. Clin Nutr 1999;18(5):259-67.
24. NICE. Nutrition support in adults: oral nutrition support, enteral tube feeding, and parenteral nutrition. National Institute for Health and Clinical Excellence (NICE) 2006; Clinical Guidelines 32.
25. Stratton RJ. Disease-realted malnutrition: an evidence-based approach to treatment. Wallingford: CABI Publishing; 2003.
26. Milne et al. Protein and energy supplementation in elderly people at risk from malnutrition. Cochrane Database Syst Rev 2005;(2):CD003288.
27. Gariballa et al. A randomized, double-blind, placebo-controlled trial of nutritional supplementation during acute illness. Am J Med
2006;119(8):693-9.
28. Langer et al. Nutritional interventions for preventing and treating pressure ulcers. Cochrane Database Syst Rev 2003(4):CD003216.
29. Stratton RJ, Elia M. Who benefits from nutritional support: what is the evidence? Eur J Gastroenterol Hepatol 2007;19(5):353-8.
30. Elia M, Stratton RJ. A cost-benefit analysis of oral nutritional supplements in preventing pressure ulcers in hospital. Clin Nutr 2005;24:640-1.
31. Rypkema et al. Cost-effectiveness of an interdisciplinary intervention in geriatric inpatients to prevent malnutrition. J Nutr Health Aging 2004;8(2):122-7.
32. Arnaud-Battandier et al. Use of oral supplements in malnourished elderly patients living in the community: a pharmaco-economic study. Clin Nutr 2004;23(5):1096-103.
33. Norman et al. Cost-effectiveness of a 3-month intervention with oral nutritional supplements in disease-related malnutrition: a randomised controlled pilot study. Eur J Clin Nutr 2011;65(6):735-42.
34. Kondrup et al. Incidence of nutritional risk and causes of inadequate nutritional care in hospitals. Clin Nutr 2002;21(6):461-8.
35. Stratton et al. Malnutrition in hospital outpatients and inpatients: prevalence, concurrent validity and ease of use of the ‘malnutrition universal screening tool’ (‘MUST’) for adults. Br J Nutr 2004;92(5):799-808.
36. Kondrup et al. ESPEN Guidelines for Nutrition Screening 2002. Clin Nutr 2003;22(4):415–21.