Comptes rendus
Progrès dans le traitement de la pneumonie nosocomiale pharmacorésistante
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PERSPECTIVE PROFESSIONNELLE - Point de vue sur des communications présentées à la 49e Assemblée annuelle de l’Infectious Diseases Society of America (IDSA)
Boston, Massachusetts / 20-23 octobre 2011
Sous la direction de :
Ethan Rubinstein, MD, LLB
Chaire de recherche H.E. Sellers en infectiologie
Chef, Section de l’infectiologie
Département de médecine interne
University of Manitoba
Winnipeg, Manitoba
Introduction
Si, il y a une vingtaine d’années, le Staphylococcus aureus méthicillino-résistant (SARM) était une cause peu fréquente de pneumonie, c’est aujourd’hui l’une des principales causes de pneumonie sévère, surtout chez les patients hospitalisés. Selon de récentes études, le SARM serait en cause dans près de 40 % des pneumonies nosocomiales (PN) ou et acquises sous ventilation (PAV). Les formes sévères de pneumonie causées par un SARM sont associées à un risque élevé de mortalité, au-delà de la barre des 30 % dans un grand nombre d’études. La présence d’un SARM étant de mauvais augure, un indice élevé de suspicion s’impose en cas de PN ou de PAV.
Dans la pneumonie à Staphylococcus aureus méthicillino-résistant (SARM), des études ont montré que l’administration précoce d’un antibiotique approprié à une dose suffisante pouvait diminuer le risque de mortalité de moitié et que le simple fait d’en retarder l’administration ou d’administrer un traitement inapproprié augmentait le risque de mortalité.
Il n’y a pas si longtemps, la vancomycine était le seul antibiotique dont nous disposions pour traiter la pneumonie à SARM. Notre expérience clinique montre que cet antibiotique est associé à de faibles taux de guérison et à un risque élevé de mortalité, principalement en raison de la faible pénétration de la vancomycine dans le tissu pulmonaire, et il n’est pas clair que des concentrations sériques plus élevées donneraient de meilleurs résultats. De plus, de fortes doses de vancomycine peuvent augmenter le risque d’effets indésirables sur la fonction rénale.
Dans ses dernières recommandations, l’Infectious Diseases Society of America (IDSA) préconise la vancomycine, le linézolide et la clindamycine pour le traitement de la pneumonie nosocomiale (PN) et de la pneumonie acquise sous ventilation (PAV) causées par un SARM (Liu et al. Clin Infect Dis 2011;52:1-38). La clindamycine n’est recommandée que chez les enfants, les données sur son utilisation chez l’adulte étant limitées.
Le linézolide, une oxazolidinone, pénètre mieux que la vancomycine dans le tissu pulmonaire et le liquide de revêtement épithélial. Des résultats d’essais avec randomisation ont d’ailleurs objectivé sa non-infériorité par rapport à la vancomycine.
Des études récentes ont éclairé notre lanterne quant à l’efficacité relative de la vancomycine et du linézolide dans le traitement de la PN et de la PAV à SARM. On a présenté au congrès de nouvelles données sur les agents actuellement à notre disposition pour le traitement des infections à SARM et sur de nouvelles options éventuelles. Considérées dans leur ensemble, ces données nous permettent d’envisager l’avenir du traitement de la pneumonie à SARM avec un certain optimisme, mais elles soulignent aussi la nécessité de poursuivre la recherche pour mieux connaître la maladie et élargir l’arsenal thérapeutique.
Résultats des essais cliniques sur la pneumonie à SARM
Les deux antimicrobiens ont fait l’objet de deux essais cliniques prospectifs d’envergure avec randomisation chez des patients atteints de PN ou de PAV à staphylocoque (Rubinstein et al. Clin Infect Dis 2001;32:402-12; Wunderink et al. Clin Ther 2003;25:
980-92). Les deux études avaient une puissance statistique suffisante pour objectiver la non-infériorité du linézolide par rapport à la vancomycine, et les résultats ont fait ressortir des similitudes entre les deux groupes quant aux taux de guérison clinique et aux taux d’éradication des agents pathogènes. Cela dit, bien que les deux essais aient porté sur un petit effectif de sujets infectés par un SARM, une analyse post hoc non planifiée des deux essais a associé le linézolide à un taux d’éradication plus élevé chez les patients infectés par le SARM.
Dans le cadre d’un essai clinique avec randomisation sur la vancomycine et le linézolide qui a été réalisé plus récemment, seuls des patients atteints de PN à SARM ont été recrutés (Wunderink et al. Clin Infect Dis 2012;54:621-9). L’essai regroupait 1184 patients atteints de PN ou de pneumonie associée aux soins de santé (PASS). Le syntagme «PASS» s’applique aux pneumonies touchant les patients vivant en foyer d’accueil ou dans un établissement de santé autre qu’un hôpital, les patients qui subissent des examens/ interventions ou reçoivent des soins en ambulatoire, les patients ayant reçu leur congé d’un hôpital peu de temps avant ainsi que certains patients immunodéprimés (Anand N, Kollef MH. Sem Respir Crit Care Med 2009;30:3-9).
Les patients ont été randomisés de façon à recevoir du linézolide à dose fixe (600 mg toutes les 12 heures) ou de la vancomycine dont la posologie avait été optimisée (15 mg/kg toutes les 12 heures). Le paramètre principal était le taux de guérison clinique (disparition des signes et des symptômes de la pneumonie; amélioration ou absence de progression de la pneumonie à la radiographie pulmonaire; et non-utilisation d’un nouvel antibactérien) au terme de l’étude chez les patients évaluables traités en vertu du protocole. Au nombre des paramètres secondaires figuraient l’issue microbiologique à la fin de l’étude (FE) et à la fin du traitement (FT), l’issue clinique à la FT au sein de la population en intention de traiter modifiée (ITm) et de la population per protocol, et l’issue clinique à la FE au sein de la population en ITm. Les autres paramètres secondaires étaient la survie des patients et l’incidence des effets indésirables. L’analyse ITm regroupait 448 sujets randomisés et l’analyse per protocol, 348 patients.
Au sein de la population per protocol, le taux de réussite clinique a atteint 57,6 % sous linézolide vs 46,6 % sous vancomycine (IC à 95 % : 0,5-21,6; p=0,042). De même, le taux de guérison à la FT était plus élevé sous linézolide (83,3 % vs 69,9 %) (Figure 1). Les taux de guérison étaient aussi plus élevés sous linézolide à la FT et à la FE au sein de la population en ITm.
Figure 1. Taux de réponse clinique selon les analyses per protocol et en intention de traiter modifiée en fin d’étude et en fin de traitement
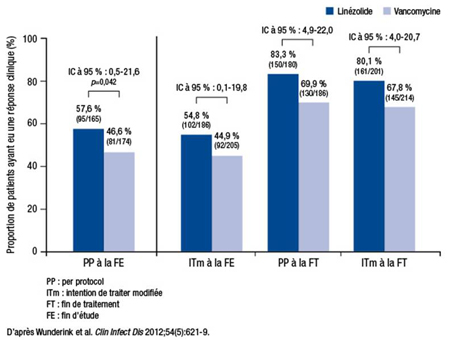
Dans l’ensemble, l’incidence et la nature des effets indésirables étaient semblables dans les deux groupes. Des effets indésirables graves liés au médicament sont survenus chez 7 patients sous linézolide (8 effets indésirables) et 13 patients sous vancomycine (18 effets indésirables). Les chercheurs ont noté une insuffisance rénale chez 3,7 % et 7,3 % des patients, respectivement, et des signes de néphrotoxicité (définie par une augmentation de 0,5 mg/mL de la créatinine sérique si la valeur initiale était normale ou par une augmentation de 50 % si elle était anormale) chez 8,4 % et 18,2 % des patients, respectivement.
La toxicité rénale était similaire dans les deux groupes chez les patients dont le débit de filtration glomérulaire (DFG) initial était <50 mL/min, mais plus fréquente sous vancomycine chez les patients dont le DFG excédait 50 mL/min (18,8 % vs 5,6 %). Dans le groupe vancomycine, les signes de toxicité rénale étaient plus fréquents si le taux minimum au jour 3 était ≥20 µg/mL (37 %) que s’il était de 15-20 µg/mL (22 %) ou <15 µg/mL (18 %). La mortalité toutes causes confondues à 60 jours était comparable dans les deux groupes.
Dans un éditorial connexe, le Dr Antoni Torres, Universitat de Barcelona, Espagne, a qualifié les résultats d’avancée dans la lutte contre le PN et la PAV à SARM (Clin Infect Dis 2012;54:630-2). Fait digne de mention, cet essai est le premier avec randomisation à regrouper exclusivement des patients atteints de pneumonie à SARM.
Bien que le linézolide et la vancomycine soient considérés comme deux options équivalentes dans les recommandations actuelles de l’IDSA, le Dr Torres estime que l’on devrait réévaluer le rôle du linézolide dans la pneumonie à SARM, compte tenu des taux de guérison obtenus et de son profil d’innocuité plus favorable pour la fonction rénale. Cela dit, bien que l’amélioration des résultats témoigne d’un progrès dans le traitement de la pneumonie à SARM, les pourcentages de guérison clinique sont encore loin d’être optimaux.
Faits saillants du congrès de l’IDSA
Le congrès annuel de l’IDSA est le forum par excellence pour tous les aspects de la recherche en cours en infectiologie, dont la pneumonie à SARM. Une brève publication comme celle-ci ne permet de faire une revue complète de toutes les études pertinentes, mais nous ferons néanmoins un tour d’horizon de quelques présentations qui témoignent du travail qui se fait en laboratoire et en clinique avec l’objectif d’améliorer les résultats dans le traitement de la pneumonie et d’autres infections à SARM.
Les micro-organismes de sensibilité intermédiaire ou clairement résistants à la vancomycine représentent une difficulté particulière. Nous avons besoin de nouvelles données sur l’activité d’antimicrobiens existants qui pourraient être des options thérapeutiques viables en cas de réponse partielle ou nulle à la vancomycine.
Saravolatz et ses collaborateurs (résumé 256) ont étudié l’activité de 13 antibiotiques contre des souches de S. aureus de sensibilité intermédiaire à la vancomycine (SAIV) ou résistantes à la vancomycine (SARV). La concentration minimale inhibitrice (CMI) et la concentration minimale bactéricide (CMB) ont été déterminées pour 33 isolats de sensibilité intermédiaire et 13 isolats résistants à la vancomycine.
Quatre agents ont été associés à une activité >90 % contre les souches de SAIV : la télavancine (100 %), le linézolide (100 %), la tigécycline (97 %) et la minocycline (94 %). L’analyse des isolats de SARV a révélé que la ceftaroline, la daptomycine, le linézolide, la minocycline et le sulfaméthoxazole-triméthoprime étaient actifs contre toutes les souches. La tigécycline et la rifampicine ont été associées à une activité de 92 %. Les six autres agents – la ceftriaxone, la télavancine, la vancomycine, la clindamycine, la gémifloxacine et la moxifloxacine – n’ont été actifs contre aucune des souches résistantes de S. aureus.
Les chercheurs en ont conclu que nous avons besoin d’expérience clinique avec ces agents afin de déterminer lesquels pourraient être utiles contre les souches de SAIV et de SARV.
Le traitement empirique dans la mire
L’IDSA et l’American Thoracic Society (ATS) ont publié une série de critères pour le diagnostic de la PN, et la mise en application de leurs recommandations fait ressortir un compromis acceptable entre la sensibilité et la spécificité de ces critères pour la sélection des patients qui devraient recevoir un traitement empirique (Am J Respir Crit Care Med 2005;171:388-416).
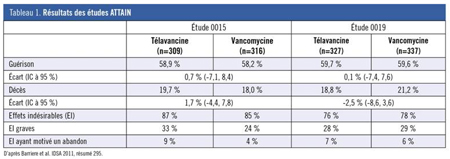
Barriere et ses collaborateurs ont appliqué rétrospectivement les critères de l’ATS/IDSA à la population adulte de deux essais cliniques de phase III de méthodologies identiques sur la télavancine et la vancomycine (résumé 295). Parmi les 1503 sujets des deux essais – qui étaient atteints de PN causée par S. aureus et d’autres micro-organismes à Gram positif –, 1289 répondaient aux critères de l’ATS/IDSA. Les chercheurs ont comparé les deux groupes de traitement quant aux taux de guérison, à la mortalité en cours d’étude et aux effets indésirables. L’analyse a fait ressortir des résultats similaires pour toutes les variables évaluées, ce qui vient étayer la conclusion initiale des essais, à savoir que la télavancine n’est pas inférieure à la vancomycine (Tableau 1).
Traitement de sauvetage en cas
de bactériémie à SARM persistante
Park et ses collaborateurs ont comparé rétrospectivement les résultats de traitements de sauvetage, l’un à base de linézolide, l’autre à base d’un glycopeptide, chez des patients atteints de bactériémie à SARM persistante malgré le traitement initial par un antibiotique de la famille des glycopeptides (résumé 570). Au sein d’une population de 377 patients atteints de bactériémie à SARM, 90 (24 %) avaient une bactériémie persistante après un traitement par un glycopeptide. Cinquante-deux des 90 patients ont poursuivi leur traitement par un glycopeptide alors que les 38 autres ont reçu du linézolide. Les taux de réussite clinique étaient similaires (74 % sous linézolide vs
70 % sous glycopeptide). Sur le plan de la mortalité à 30 jours, par contre, les résultats penchaient en faveur du premier groupe (11 % vs 25 %, p=0,08), et il en allait de même pour la mortalité liée à S. aureus (5 % vs 17 %, p=0,08).
Autres traitements possibles dans la PAV
La colistine intraveineuse (i.v.) ne pénètre pas bien dans le parenchyme pulmonaire, de sorte que son utilisation dans le traitement de la pneumonie est controversée. Lorsqu’elle est administrée en inhalation, par contre, la colistine atteint de fortes concentrations dans le tissu de l’appareil respiratoire et n’entraîne pas les EI d’un traitement systémique. Cependant, nous avons peu d’expérience clinique avec la colistine en dehors de la fibrose kystique.
Florescu et ses collaborateurs ont réalisé une méta-analyse d’essais cliniques avec randomisation afin d’évaluer l’utilité éventuelle de la colistine dans le traitement de la PAV (résumé 299). L’analyse regroupait 6 études et 359 patients dont 186 ont reçu de la colistine (i.v. ou en inhalation) et 173, un autre antibiotique. Dans l’ensemble, les résultats obtenus avec la colistine ne différaient pas de manière significative des résultats obtenus avec les agents de comparaison (OR 1,14 pour la réponse clinique). L’analyse des résultats de la colistine par voie d’administration n’a fait ressortir aucune différence entre la préparation nébulisée et la préparation i.v.
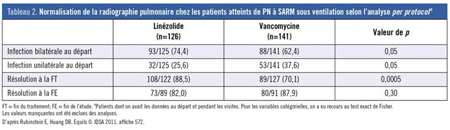
Les investigateurs d’un essai clinique de phase IV avec randomisation ont réalisé une analyse post hoc afin de comparer les résultats du traitement par le linézolide et du traitement par la vancomycine chez des patients atteints de PAV à SARM (confirmé par culture) (résumé 572). Plus précisément, ils ont analysé le délai de résolution des signes et des symptômes dans chaque groupe. Les résultats ont objectivé des taux de résolution plus élevés sous linézolide aux jours 3 et 6 – notamment sur le plan des râles, de la consolidation pulmonaire et de l’hypoxémie –, mais l’écart entre les groupes n’était pas significatif. Chez les patients sous vancomycine, les taux de résolution des symptômes ont graduellement rattrapé, voire dépassé, les taux obtenus sous linézolide à la FT et à la FE. Aucun des écarts observés n’était statistiquement significatif. À la FT, les patients sous linézolide étaient significativement plus nombreux à avoir des bruits respiratoires normaux (p=0,003) et une radiographie pulmonaire normale (88,5 % vs 70.1 %, p=0,0005) (Tableau 2).
Regard sur l’avenir
La mise au point de nouveaux agents pour le traitement de la pneumonie à SARM se poursuit sans relâche, et plusieurs nouveaux agents pourraient voir le jour dans un avenir prochain. Au nombre des agents prometteurs figurent le PTK 0796, premier représentant d’une nouvelle classe d’antibiotiques à large spectre connus sous le nom d’aminométhylcyclines (qui sera offert en préparations orale et injectable par voie i.v.); l’acide fusidique, antibiotique bactériostatique oral actif contre les agents pathogènes à Gram positif, y compris les souches de SARM responsables de la PN; le LCB01-0371, oxazolidinone à large spectre qui s’est révélée aussi efficace, voire plus efficace, que plusieurs agents déjà sur le marché; et le LTX-109, un peptidomimétique synthétique qui lyse la membrane et dont on étudie une formulation topique pour éliminer la colonisation nasale.
L’apparition de souches résistantes est un problème grandissant, et de nouveaux traitements plus efficaces s’imposent. L’IDSA a lancé une initiative pour encourager le développement de 10 nouveaux antibiotiques d’ici 2020. Intitulé «10 by 20 Initiative», ce programme a été mis sur pied pour favoriser la collaboration entre les facultés de médecine, l’industrie et les instances gouvernementales et, en définitive, accélérer la commercialisation de nouveaux antibiotiques.
Résumé
La pneumonie à SARM représente un énorme problème de santé publique. L’apparition de souches résistantes, qui vient exacerber le problème, découle en grande partie de l’utilisation excessive et inappropriée des antibiotiques. La vancomycine, depuis longtemps le traitement de référence lorsque des souches résistantes, y compris le SARM, sont en cause, est associée à des résultats sous-optimaux. Quelques nouveaux agents se sont révélés prometteurs comme solutions de rechange à la vancomycine, mais nous avons tout de même besoin de nouvelles options, car les problèmes liés à l’apparition de souches résistantes persistent malgré la commercialisation de nouveaux agents depuis quelques années. Plusieurs agents actuellement en développement pourraient se révéler efficaces contre les infections causées par un SARM ou d’autres micro-organismes résistants. Notre quête de nouveaux traitements plus efficaces doit se poursuivre, mais nous devons en parallèle continuer d’élaborer des stratégies efficaces pour prévenir les infections et favoriser l’usage approprié des antibiotiques actuellement à notre disposition.