Comptes rendus
Traitement des lymphomes indolents : l’efficacité et la tolérabilité s’améliorent
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PERSPECTIVE PROFESSIONNELLE - Point de vue sur la littérature : Rummel et al. Lancet 2013;381(9873):1203-10.`
mai 2013
Sous la direction de :
Laurie H. Sehn, MD, MPH
Professeure agrégée de clinique
BC Cancer Agency et
The University of British Columbia
Vancouver (Colombie-Britannique)
Introduction
De plus en plus, les résultats d’études cliniques favorisent l’obtention d’un consensus sur la démarche optimale dans le traitement de première intention des lymphomes indolents, un sous-type de lymphome non hodgkinien (LNH). S’il était jadis difficile de conclure à la supériorité d’un agent en particulier dans le traitement des lymphomes indolents, nous savons maintenant à la lumière d’essais avec randomisation que plusieurs agents sont associés à un gain de survie dans divers sous-types de lymphomes indolents, comme le lymphome folliculaire symptomatique. Dans le cadre de la plus récente étude de phase III, on a comparé le schéma bendamustine + rituximab au schéma fort répandu CHOP-R (cyclophosphamide/doxorubicine/ vincristine/prednisone + rituximab). Le schéma bendamustine + rituximab a été associé à une prolongation significative de la survie sans progression (SSP) tout en étant mieux toléré. Une meilleure tolérabilité est importante dans le contexte d’un lymphome indolent, car il est essentiel que la qualité de vie soit optimale du fait que la survie est longue. Il se peut qu’il n’y ait jamais de traitement de référence universel dans les lymphomes indolents en raison de l’hétérogénéité de ces cancers, mais les objectifs du traitement sont maintenant plus clairs.
Contexte général
«Lymphome indolent» est un terme qui s’utilise pour décrire un sous-groupe hétérogène de LNH caractérisés par un parcours chronique ponctué de rechutes et de rémissions et, souvent, par une survie prolongée. Vu la lente progression des LNH indolents (LNHi), l’attente vigilante était jadis la conduite à tenir dans la majorité des cas, même en présence de symptômes1. Cette démarche, encore monnaie courante dans la prise en charge des LNHi asymptomatiques, était motivée par la crainte d’imposer une toxicité en échange d’une amélioration clinique modeste ou négligeable. Les avantages du traitement en cas de maladie symptomatique ont été bien établis grâce à une série d’études cliniques avec randomisation ayant montré fois après fois que le rituximab, anticorps monoclonal anti-CD20, était associé à une forte activité et à une bonne tolérabilité en monothérapie ou en association1-7. Compte tenu de cette activité, y compris un gain de survie, lorsque le rituximab est associé au schéma CHOP (cyclophosphamide, doxorubicine, vincristine et prednisone [CHOP-R])3, plusieurs sociétés savantes préconisent un schéma à base de rituximab dans le traitement des LNHi8,9.
Les lymphomes indolents, dits aussi de bas grade ou de faible malignité, représentent environ 40 à 50 % des quelque 7800 LNH diagnostiqués chaque année au Canada10. En raison de la nature descriptive du terme, l’Organisation mondiale de la Santé (OMS) a abandonné «indolent» au profit d’une classification axée sur la cellule d’origine et la physiopathologie11. Le sous-type histologique de lymphome indolent le plus fréquent – le lymphome folliculaire (LF) – représente environ 20 % de tous les lymphomes et provient des cellules B germinales12.
Parmi les 30 types de LNH décrits, la plupart dérivés de cellules B et non de cellules T, on a encore du mal à déterminer si certains sont agressifs ou indolents. Le lymphome du manteau (LM), par exemple, représente 3 à 10 % des LNH; il est assorti d’un pronostic assez sombre, mais il est indolent chez certains patients; de temps à autre, on l’inclut dans les essais cliniques sur le traitement des lymphomes indolents13.
Évolution de la prise en charge
d’un lymphome indolent
L’attente vigilante, en vigueur dans les années 1980, reposait sur une série d’études qui n’avaient pas réussi à objectiver de prolongation de la survie chez des patients atteints d’un LNH de bas grade lorsque le traitement était amorcé plus tôt14,15. L’amélioration subséquente de l’activité des nouveaux agents thérapeutiques, le rituximab en particulier, justifie maintenant que l’on traite les LNHi symptomatiques16.
Dans les essais à l’appui d’un traitement actif, on s’est employé à faire ressortir une amélioration de données cliniques pertinentes telles que l’intervalle sans échec du traitement ou la survie sans progression (SSP) dans un contexte de tolérabilité acceptable afin d’assurer un ratio bénéfice:risque favorable.
Plusieurs études d’envergure ont étayé l’association du rituximab et de la chimiothérapie dans les LNHi symptomatiques. Dans un essai de phase III avec randomisation, le schéma cyclophosphamide/vincristine/prednisone + rituximab (CVP-R) a été comparé au schéma CVP seul chez 321 patients dont le LF de stade 3 ou 4 n’avait encore jamais été traité7. Huit cycles de traitement ont été administrés dans chaque groupe. À en juger par l’intervalle sans échec du traitement, le paramètre principal, l’avantage du schéma CVP-R était hautement significatif (p<0,0001). En outre, le schéma CVP-R a amélioré à la fois l’intervalle sans progression (p<0,0001) et la survie globale (SG) à 4 ans (83 % vs 77 %; p=0,029). L’avantage relatif du rituximab demeurait, quels qu’aient été le volume tumoral ou la catégorie de risque selon le score FLIPI (Follicular Lymphoma International Prognostic Index). Là encore, l’ajout du rituximab a été bien toléré, mais la myélosuppression a été plus fréquente dans le groupe CVP-R.
Dans une étude de phase III subséquente, on a comparé le schéma CHOP-R au schéma CHOP chez 428 sujets randomisés dont le LF de stade avancé n’avait jamais été traité3. Par rapport au schéma CHOP, le schéma CHOP-R a été associé à un taux de réponse globale plus élevé (p=0,011) de même qu’à une prolongation significative de l’intervalle sans échec du traitement (p<0,001) et de la rémission (p=0,001). Sur le plan de la SG, une légère différence en faveur du schéma CHOP-R a aussi atteint le seuil de significativité statistique (p=0,016). Par rapport au schéma CHOP seul, le schéma avec rituximab a été bien toléré, et l’écart entre les groupes quant aux effets indésirables se limitait en grande partie aux réactions liées à la perfusion et à la myélosuppression.
Tableau 1. Résultats de l’essai FOLLO5 après un suivi de 34 mois (médiane)
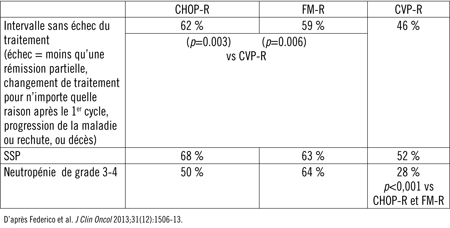
À la suite de ces essais, les schémas CHOP-R et CVP-R ont gagné en popularité. L’efficacité relative de ces traitements – qui n’avait jamais été évaluée au départ – a fait l’objet d’une étude à trois groupes dont les résultats, présentés récemment, ont montré que les schémas CHOP-R et fludarabine/mitoxantrone + rituximab (FM-R) pourraient être plus efficaces que le schéma CVP-R17.
Dans cette étude, 534 patients atteints d’un LF avancé ont été randomisés. Après un suivi de 34 mois (médiane), les schémas CHOP-R (p=0,003) et FM-R (p=0,006) ont été associés à un intervalle sans échec du traitement significativement plus long, comparativement au schéma CVP-R (Tableau 1). Les taux de SSP étaient aussi significativement plus élevés sous CHOP-R et FM-R que sous CVP-R, mais les taux de SG étaient similaires. Les trois schémas ont été bien tolérés, mais le schéma FM-R a été associé à une toxicité globale plus marquée, en particulier un taux significativement plus élevé de neutropénie de grade ≥3 et un taux plus élevé de cancers secondaires.
Données de phase III axées
sur le ratio bénéfice:risque
Les chimiothérapies standard exercent un effet favorable sur les résultats cliniquement pertinents, mais leur toxicité demeure généralement une source d’inquiétude dans un contexte où la qualité de vie devrait être préservée durant une période de survie prolongée. Parmi les agents de rechange que l’on peut associer au rituximab, la bendamustine, un agent cytotoxique alkylant, suscite de l’intérêt parce qu’elle exerce une activité durable chez les patients réfractaires à d’autres traitements et qu’elle est associée à un risque relativement faible d’effets indésirables qui minent la qualité de vie comme l’alopécie et la neuropathie périphérique18,19. La bendamustine a d’abord été homologuée aux États-Unis en 2008, mais elle est utilisée dans la pratique clinique depuis déjà une vingtaine d’années en Allemagne, où elle est homologuée pour le traitement des lymphomes réfractaires au rituximab20.
Dans un essai de phase III qui vient de s’achever, on a comparé le schéma bendamustine + rituximab (B-R) au schéma CHOP-R dans le traitement des LNHi et des LM afin de vérifier l’hypothèse voulant que le schéma B-R soit non inférieur au schéma CHOP-R et mieux toléré21. Le groupe d’étude StiL a lancé cet essai en 2003 et 81 centres allemands y ont participé. Le paramètre principal était la SSP alors que les paramètres secondaires étaient le taux de réponse globale (RG), le taux de réponse complète (RC), l’intervalle sans traitement antilymphomateux et la toxicité. Les principaux critères d’admission étaient un lymphome indolent ou un LM de stade III ou IV et un indice fonctionnel ≤2 selon la classification de l’OMS. Les sous-types suivants de LNHi ont été évalués : LF, lymphome lymphoplasmocytaire (macroglobulinémie de Waldenström), lymphome à petits lymphocytes et lymphome de la zone marginale.
Dans le cadre d’un essai ouvert, 274 patients ont été randomisés de façon à recevoir le schéma B-R et 275, le schéma CHOP-R. Dans les deux groupes, le rituximab était administré à raison de 375 mg/m2 le jour 1 de chaque cycle. Dans la bithérapie administrée toutes les 4 semaines, la bendamustine était administrée à raison de 90 mg/m2 les jours 1 et 2. Le schéma CHOP – administré toutes les 3 semaines – comportait 750 mg/m2 de cyclophosphamide, 50 mg/m2 de doxorubicine et 1,4 mg/m2 de vincristine, tous administrés le jour 1, alors que la prednisone était administrée à raison de 100 mg/jour du 1er au 5e jour du cycle. Les deux groupes recevaient un maximum de 6 cycles. Aucun schéma d’entretien n’a été administré.
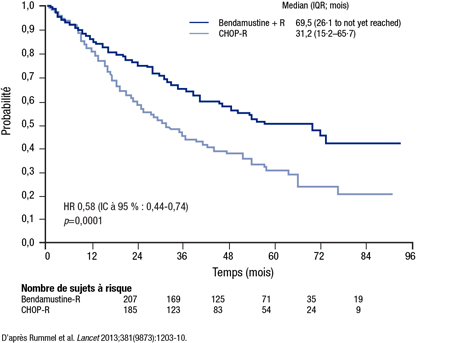
Après un suivi d’une durée médiane de 45 mois, la médiane de SSP a atteint 69,5 mois sous B-R vs 31,2 mois sous CHOP-R, ce qui donne lieu à une diminution du risque relatif (HR) de 42 % (HR 0,58; IC à 95 %, 0,44-0,75; p<0,0001) (Figure 1). L’avantage relatif du schéma B-R était indépendant de l’âge, du taux de lactate déshydrogénase et du score FLIPI. Le schéma B-R a aussi été associé à de meilleurs résultats à en juger par de nombreux paramètres secondaires, notamment le taux de RC (40 % vs 30 %; p=0,021) et l’intervalle sans traitement antilymphomateux (médiane non atteinte vs 42,3 mois; p<0,0001). Cependant, la SG ne différait pas d’une cohorte à l’autre (p=n.s.).
Figure 1. SSP dans l’essai du groupe StiL
Les effets indésirables ont été moins fréquents sous B-R. Chez les patients qui ont reçu au moins 3 cycles de traitement, on a observé des taux significativement plus faibles d’alopécie (0 % vs 100 %), de neuropathie périphérique (7 % vs 29 %; p<0,0001) et de stomatite (6 % vs 19 %; p<0,0001). Les réactions cutanées érythémateuses, plus fréquentes sous B-R (16 % vs 9 %; p=0,024), ont fait exception. Dans l’ensemble, les effets neurotoxiques ont été 4 fois plus fréquents sous CHOP-R que sous B-R.
La plupart des effets hématologiques ont également été significativement moins fréquents sous B-R que sous CHOP-R; ce fut le cas de la leucopénie de grade 3 ou 4 (p<0,0001) et de la neutropénie de grade 3 ou 4 (p<0,0001). La lymphopénie a toutefois été plus fréquente sous B-R (grade ≥3, 74 % vs 43 %; valeur de p non divulguée). Les épisodes infectieux tous grades confondus ont quant à eux été plus fréquents sous CHOP-R que sous B-R (50 % vs 37 %; p=0,0025). Les sepsis ont été peu fréquents dans un groupe comme dans l’autre, mais ils ont été significativement plus fréquents sous CHOP-R (3 % vs <1%; p=0,019). Les patients sous B-R étaient moins susceptibles de recevoir un facteur de croissance hématopoïétique. Un cancer secondaire a été signalé chez 20 patients sous B-R, comparativement à 23 patients sous CHOP-R.
Au sein des quatre principaux sous-groupes histologiques de cette étude (LF, LM, macroglobulinémie de Waldenström et lymphome de la zone marginale), le gain de SSP sous B-R (vs CHOP-R) était statistiquement significatif dans tous les cas, sauf chez les patients atteints d’un lymphome de la zone marginale. Exprimé en HR, cet avantage se chiffrait à 0,61 pour le LF (p=0,0044), à 0,49 pour le LM (p=0,0044), à 0,33 pour la macroglobulinémie de Waldenström (p=0,0033) et à 0,7 pour le lymphome de la zone marginale (p=0,3279). Le petit nombre de sujets dans ce dernier sous-groupe pourrait expliquer que l’avantage n’ait pas atteint le seuil de significativité statistique.
À la lumière des résultats d’une étude rapportée antérieurement22, plusieurs société savantes, dont le National Comprehensive Cancer Network (NCCN) et la European Society of Medical Oncology (ESMO), ont mis leurs recommandations à jour et préconisent maintenant le schéma B-R dans le traitement de première intention des lymphomes indolents. Au Canada, les résultats de cette étude ont amené le pCODR (pan-Canadian Oncology Drug Review) à prendre une décision favorable au sujet du schéma P-R et les autorités de plusieurs provinces à opter pour le schéma B-R dans le traitement de première intention des LNHi et des LM.
Conclusion
Au vu du nombre croissant d’options efficaces, le traitement des lymphomes indolents vise principalement à obtenir une maîtrise durable de la maladie tout en réduisant la toxicité au minimum. Le ratio bénéfice:risque des agents actifs de première intention demeure une importante source d’inquiétude du fait que l’on recherche une qualité de vie optimale. Par rapport au schéma CHOP-R, qui a été associé à des taux élevés d’activité comparativement à d’autres schémas à base de rituximab, le schéma B-R pourrait devenir l’option privilégiée du fait de sa plus grande efficacité et de sa meilleure tolérabilité. Dans le traitement des lymphomes indolents, les prochaines étapes reposeront encore sur des traitements qui exercent une activité plus marquée tout en causant le moins possible d’effets indésirables.
Références
1. Lunning MA, Vose JM. Management of indolent lymphoma: where are we now and where are we going. Blood Rev 2012;26(6):279-88.
2. Lowry L, Ardeshna KM. Has single-agent rituximab replaced watch-and-wait for a patient with asymptomatic low-grade follicular lymphoma? Cancer J 2012;18(5):390-5.
3. Hiddemann et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 2005;
106(12):3725-32.
4. Herold et al. Rituximab added to first-line mitoxantrone, chlorambucil, and prednisolone chemotherapy followed by interferon maintenance prolongs survival in patients with advanced follicular lymphoma: an East German Study Group Hematology and Oncology Study. J Clin Oncol 2007;25:1986-92.
5. Marcus et al. CVP chemotherapy plus rituximab compared with CVP as first-line treatment for advanced follicular lymphoma. Blood 2005;105:1417-23.
6. Salles et al. Rituximab combined with chemotherapy and interferon in follicular lymphoma patients: results of the GELA-GOELAMS FL2000 study. Blood 2008;112:4824-31.
7. Marcus et al. Phase III study of R-CVP compared with cyclophosphamide, vincristine, and prednisone alone in patients with previously untreated advanced follicular lymphoma. J Clin Oncol 2008;26(28):4579-86.
8. Zelenetz et al. NCCN Clinical Practice Guidelines in Oncology: non-Hodgkin’s lymphomas. Version 1.2013. 2013: Available at: www.nccn.org.
9. Ghielmini et al. ESMO Guidelines consensus conference on malignant lymphoma 2011 part 1: diffuse large B-cell lymphoma (DLBCL), follicular lymphoma (FL), and chronic lymphocytic leukemia (CLL). Ann Oncol 2013;24:561-76.
10. NHL Statistics. 2012. (Accessed March 7, 2013, at http://www.nhlcyberfamily.org/statistics.htm#canada.)
11. Jaffe et al. World Health Organization Classification of Tumours: Pathology and Genetics of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press 2001.
12. A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin’s lymphoma. The Non-Hodgkin’s Lymphoma Classification Project. Blood 1997;89(11):3909-18.
13. Hoster et al. A new prognostic index (MIPI) for patients with advanced-stage mantle cell lymphoma. Blood 2008;111(2):558-65.
14. Horning SJ, Rosenberg SA. The natural history of initially untreated low-grade non-Hodgkin’s lymphomas. N Engl J Med 1984;311(23):1471-5.
15. Young et al. The treatment of indolent lymphomas: watchful waiting v aggressive combined modality treatment. Semin Hematol 1988;25(2 Suppl 2):11-6.
16. McLaughlin P. Progress and promise in the treatment of indolent lymphomas. Oncologist 2002;7(3):217-25.
17. Federico et al. R-CVP versus R-CHOP versus R-FM for the initial treatment of patients with advanced-stage follicular lymphoma: results of FOLLO5 trial conducted by the Fondazione Italiana Linfomi. J Clin Oncol 2013; 2013;31(12):1506-13.
18. Cheson BD, Rummel MJ. Bendamustine: rebirth of an old drug. J Clin Oncol 2009;27(9):1492-501.
19. Rummel MJ, Gregory SA. Bendamustine’s emerging role in the management of lymphoid malignancies. Semin Hematol 2011;48 Suppl 1:S24-36.
20. Kahl et al. Bendamustine is effective therapy in patients with rituximab-refractory, indolent B-cell non-Hodgkin lymphoma: results from a Multicenter Study. Cancer 2010;116(1):106-14.
21. Rummel et al. Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 2013;381(9873):1203-10.
22. Rummel et al. Bendamustine plus rituximab (B-R) versus CHOP plus rituximab (CHOP-R) as first-line treatment in patients with indolent and mantle cell lymphomas (MCL): Updated results from the StiL NHL1 study. J Clin Oncol 2012;30:(suppl;abstr 3).