Comptes rendus
Traitement et prévention de la thrombose veineuse en présence d’un cancer
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
FRONTIÈRES MÉDICALES - 6e Conférence internationale sur la thrombose et l’hémostase dans le cancer (ICTHIC)
Bergame, Italie / 20-22 avril 2012
Bergame - Le cancer est un état d’hypercoagulabilité qui se caractérise par un risque accru de thrombose durant toute la période d’activité de la maladie, surtout en présence de métastases. En outre, les chimiothérapies antiangiogéniques augmentent significativement le risque d’embolie, tout comme la chirurgie et les cathéters veineux centraux. Jamais bénigne, la thromboembolie veineuse (TEV) mine la qualité de vie des patients atteints de cancer et peut même être mortelle. Les héparines de bas poids moléculaire (HBPM) sont largement recommandées, car elles constituent la stratégie la plus efficace pour le traitement et la prévention de la TEV en présence d’un cancer. La prévention primaire de la TEV demeure controversée, mais certaines données semblent indiquer que les HBPM pourraient prolonger la durée de survie en prévenant la TEV chez les patients dont le cancer est peu avancé et qu’elles pourraient améliorer le pronostic si elles étaient utilisées assez tôt en présence d’un cancer dont le risque thrombotique est très élevé.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
Cancer et risque thrombotique
Le risque de thromboembolie veineuse (TEV) varie selon le type de cancer, mais ce sont probablement les hémopathies malignes, les cancers du poumon et les cancers digestifs qui exposent le patient au risque de thrombose le plus élevé. Les cancers du pancréas, de la prostate et du côlon sont également associés à un état thrombogène qui se caractérise par des anomalies des facteurs de coagulation. La probabilité de TEV augmente aussi chez les patients atteints d’un cancer avancé, à plus forte raison si ce cancer est métastatique. Le risque de thrombose atteint un maximum à plusieurs étapes de la maladie. «La TEV est la complication la plus fréquente du cancer et la deuxième cause de mortalité – derrière la progression du cancer – chez les patients dont la maladie est active», explique le Dr Alexander Cohen, King’s College Hospital, Londres, Royaume-Uni.
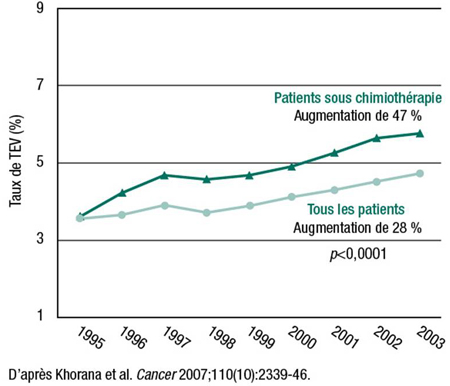
De plus, l’incidence de la TEV est à la hausse chez les patients atteints de cancer. De 1995 à 2003, le taux de TEV chez les patients sous chimiothérapie a fait un bond de 47 % (Cancer 2007;110[10]:2339-46) (Figure 1). D’autres études ont objectivé des signes radiologiques de TEV chez 50 % des patients atteints d’un cancer avancé qui étaient placés en établissement de soins de longue durée, ce qui donne tout lieu de croire que la TEV est nettement sous-diagnostiquée chez de nombreux patients cancéreux. C’est le cas, par exemple, des patients atteints d›un cancer du poumon, les signes d’une embolie pulmonaire (EP) étant très semblables à ceux du cancer. «À mesure que leur état s’aggrave, les patients sont de moins en moins mobiles et l’alourdissement graduel du fardeau tumoral s›accompagne d’une augmentation croissante de la coagulabilité, précise le Dr Simon Noble, Cardiff University, Royaume-Uni. N’oublions pas non plus les quelques patients atteints d’un cancer du poumon qui, après avoir été opérés et avoir reçu des chimiothérapies, ne peuvent plus recevoir de traitement pour contrer la progression de la maladie : ces patients sont d’autant moins mobiles que leur fardeau de comorbidité (infections, insuffisance cardiaque) est lourd.
«On dit que 50 % des patients atteints de cancer présentent des signes de thrombose à l’autopsie et que le taux de mortalité est très élevé chez les patients atteints de cancer qui développent une TEV. C’est donc dire que les complications thrombotiques du cancer représentent un énorme fardeau», affirme la Dre Agnes Lee, professeure agrégée de médecine, University of British Columbia, et directrice du programme sur la thrombose, Vancouver General Hospital. «Si nous nous efforcions davantage de prévenir la TEV, nous pourrions faire reculer la mortalité.»
Preuves à l’appui des HBPM
Dans tous les guides de pratique reconnus, la monothérapie par une héparine de bas poids moléculaire (HBPM) demeure la stratégie recommandée pour contrer la thrombose en présence d’un cancer. Ces recommandations se fondent sur les résultats de trois essais comparatifs avec randomisation (ECR) lors desquels on a comparé l’une de trois HBPM – la daltéparine, l’énoxaparine et la tinzaparine – à la warfarine chez des patients ayant subi une thrombose veineuse profonde (TVP) proximale symptomatique ou une embolie pulmonaire (EP).
Figure 1. Taux de TEV chez les patients atteints de cancer
Lors de l’essai CLOT (Randomized Comparison of Low-Molecular-Weight Heparin versus Oral Anticoagulant Therapy for the Prevention of Recurrent Venous Thromboembolism in Patients with Cancer) (N Engl J Med 2003;349:146-53), la daltéparine a été administrée à raison de 200 UI/kg/jour le premier mois, puis de 75 à 83 % de cette dose pendant 5 mois. Dans les deux autres études, l’HBPM était administrée durant seulement 3 mois. «Les trois essais ont montré systématiquement que l’HBPM était plus efficace que la warfarine pour réduire le risque de récurrence d’une TEV», souligne la Dre Lee.
Toujours dans l’essai CLOT, la daltéparine a réduit le risque de thrombose récurrente symptomatique de 52 % par rapport à la warfarine, et il n›y avait aucune différence entre les deux groupes de traitement quant aux hémorragies majeures. L’analyse groupée des trois ECR réalisée par la Collaboration Cochrane a mis en évidence une réduction de 53 % de l’incidence de la TEV chez les patients atteints de cancer, ce qui correspond d’assez près aux résultats de l’essai CLOT (Cochrane Database Syst Rev 2011;CD006650) (Tableau 1).
Prise en charge suggérée
À l’heure actuelle, on ignore la durée optimale du traitement anticoagulant dans la thrombose associée au cancer. À en juger par les guides de pratique, le traitement devrait se poursuivre pendant 3 à 6 mois, tant que le cancer est actif et tant que le patient est sous chimiothérapie. Au-delà de cette période, un traitement «indéfini» est recommandé en présence de métastases à cause du risque élevé de TEV qui leur est associé.
«Nous devons aussi adapter le traitement aux besoins du patient», ajoute la Dre Lee. Le traitement par la warfarine a divers inconvénients, notamment le besoin fréquent d’examens de laboratoire et de prélèvements sanguins pour la surveillance de l’INR ainsi que de nombreuses interactions médicamenteuses et restrictions alimentaires.
Par contre, les HBPM coûtent plus cher que la warfarine et doivent être injectées chaque jour par voie sous-cutanée (s.c.). Advenant une TEV récurrente sous warfarine, on doit passer à une HBPM et, advenant l’échec du traitement par une HBPM, on doit augmenter la dose de 20 à 25 % et réévaluer le patient après 5 à 7 jours afin de déterminer si ses symptômes se sont atténués.
La pose d’un filtre dans la veine cave inférieure est monnaie courante chez les patients en proie à une TEV pour qui le traitement anticoagulant est contre-indiqué, mais il n’existe aucune raison biologique pour que ces filtres fonctionnent puisqu›ils n›exercent aucun effet anticoagulant. «Je recommande de ne pas poser ces filtres en raison de l’hypercoagulabilité qui caractérise le cancer», poursuit la Dre Lee.
Tableau 1. Risque de TEV récurrente associé aux HBPM

Prévention de la TEV postopératoire
La chirurgie demeure la pierre angulaire du traitement dans la prise en charge des tumeurs solides, plus de 80 % des patients se faisant opérer au cours de leur maladie. La chirurgie, souvent envisagée au début de la maladie, a une finalité curative ou vise à tout le moins à exercer des effets palliatifs prolongés. «La prévention d’une complication potentiellement mortelle comme la TEV doit donc être l’une de nos grandes priorités», affirme le Dr Ajay Kakkar, professeur titulaire de chirurgie, University College, et directeur, Thrombosis Research Institute, Londres, Royaume-Uni.
Dans les guides de pratique, on recommande d’administrer de l’héparine par voie s.c. avant l’intervention, puis d’amorcer un traitement anticoagulant continu de 12 à 24 heures après l’intervention chirurgicale. La thromboprophylaxie doit se poursuivre durant au moins 7 à 10 jours après l’intervention. Une revue de la Collaboration Cochrane qui regroupait des patients opérés pour un cancer au niveau de l’abdomen, du pelvis ou du thorax a révélé qu’une thromboprophylaxie prolongée après la résection du cancer avait réduit le taux de TVP de plus de 50 % et le taux de TVP proximale de 75 % par rapport à une prophylaxie de 7 à 10 jours (Cochrane Database Syst Rev 2009;CD004318).
De même, un essai à double insu mené plus récemment chez des patients opérés pour un cancer au niveau de l’abdomen ou du pelvis a permis de constater qu’une thromboprophylaxie prolongée par la bémiparine, une autre HBPM, avait diminué le taux de TEV majeure sans pour autant augmenter le taux de complications hémorragiques (J Thromb Haemost 2010;8:1223-9). Ces résultats ont amené plusieurs sociétés savantes à recommander une thromboprophylaxie prolongée chez tous les patients qui doivent subir une intervention chirurgicale non urgente, mais certaines d’entre elles, comme l’ASCO, la recommandent uniquement pour les patients cancéreux à risque élevé de thrombose qui subissent une intervention abdominale ou pelvienne majeure.
«Pour que la prophylaxie intrahospitalière soit bénéfique, nous savons que les patients atteints de cancer doivent recevoir une dose plus forte d’HBPM qu’un patient ne souffrant pas de cancer», fait remarquer le Dr Kakkar. Ce dernier a d’ailleurs cité une étude dans laquelle la daltéparine à forte dose (5000 unités) avait diminué l’incidence de la TEV par rapport à la daltéparine à 2500 unités (8 % vs 15 %).
Prévention primaire de la thrombose
S’il est clair que les HBPM sont les agents de prédilection pour le traitement et la prévention secondaire de la TEV, leur utilité pour la thromboprophylaxie primaire chez des patients ambulatoires sous chimiothérapie demeure controversée. Comme l’ont souligné quelques conférenciers, certaines chimiothérapies, surtout celles qui reposent sur des inhibiteurs de l’angiogenèse, sont associées à un risque accru de TEV. Dans le contexte de certaines hémopathies malignes et notamment du myélome multiple (MM), le risque de TEV augmente radicalement en raison des multiples agents que comprennent les schémas, notamment la thalidomide ou le lénalidomide.
En raison de l’incidence élevée de la TEV dans cette population, «la thromboprophylaxie est principalement utilisée au cours du traitement d›induction», précise le Dr Frank Leebeek, Centre médical de l’Université Érasme, Rotterdam, Pays-Bas. Le schéma antithrombotique optimal en présence d’un MM n’est pas clair, mais les données semblent indiquer que l’utilisation d’une HBPM à des fins prophylactiques ou de la warfarine – qu’il s’agisse d’un traitement de forte intensité (INR cible de 2 à 3) ou à dose fixe – permet de réduire le risque de complications thromboemboliques associées au MM.
Récemment, le Pr Giancarlo Agnelli, Università degli studi di Perugia, Italie, et ses collaborateurs ont signalé qu’après 3,5 mois de traitement (médiane), la semuloparine, une HBPM, avait permis une diminution significative de 64 % du risque relatif d’événement thrombotique par rapport à un placebo (N Engl J Med 2012;366:601-9). «On a objectivé des effets homogènes dans différents types de cancer de même que pour chacun des éléments du paramètre mixte, soit la TVP symptomatique, les EP tous types confondus et l’EP non mortelle.» Le risque hémorragique ne s’élevait qu’à environ 1 % dans chacun des deux groupes de traitement.
Lors de l’essai TOPIC-2, la certoparine administrée à des fins prophylactiques a été associée à une tendance vers l’efficacité dans le cancer du poumon non à petites cellules (CPNPC) avancé, tandis que le risque de TEV s’élevait à 8,3 % chez les sujets sous placebo, ce qui démontre que le CPNPC expose le patient à un risque très élevé de thrombose (Clin Appl Thromb Hemost 2012;18:159-65). L’analyse groupée des essais PROTECHT et TOPIC-2 montre que «le nombre de patients atteints de CPNPC qu’il faut traiter pour prévenir un cas de TEV est de 31 alors que le nombre de patients qu’il faut traiter pour obtenir un effet nocif est de 125. Personnellement, j’estime que ces résultats sont très impressionnants. En outre, toujours chez les patients atteints de cancer, le coût du traitement d’une TEV est significativement plus élevé que le coût de la prévention», affirme le Dr Noble.
Effet anticancéreux potentiel
Certains avancent que les HBPM pourraient prolonger la survie non seulement parce qu’elles préviennent les TEV potentiellement mortelles, mais aussi parce qu’elles exercent des effets anticancéreux directs. Il ressort de données précliniques que les mécanismes de l’hémostase sont liés très étroitement à la croissance et à la prolifération des cellules tumorales, la thrombine servant de facteur de croissance pour l’angiogenèse.
Les HBPM peuvent aussi atténuer l’essaimage des cellules cancéreuses à partir de la tumeur primaire et influencer de multiples étapes de la cascade métastatique, diminuant entre autres l’inflammation, l’angiogenèse et l’adhésion des cellules endothéliales. Lors de l’essai FAMOUS, bien qu’il n’y ait pas eu de différence entre la daltéparine et un placebo quant à la survie à 1 an chez des patients porteurs d’une tumeur solide avancée, une analyse post-hoc de la survie estimée à 2 et à 3 ans a montré qu’il semblait y avoir un gain de survie chez les patients dont le cancer était de meilleur pronostic au moment de l’admission à l’étude et qui étaient toujours en vie à 17 mois (J Clin Oncol 2004;22[10]:1944-48).
De plus, comme le souligne le Dr Noble, «on a mis fin au traitement par l’HBPM après 12 mois, de sorte que le gain de survie ne peut pas tenir à la thromboprophylaxie. Selon l’une des hypothèses, l’HBPM exercerait un effet quelconque sur la maladie et la survie s’en trouverait ainsi prolongée.» Altinbas et ses collaborateurs (J Thromb Haemost 2004;8:1266-71) ont pour leur part constaté que l’ajout de la daltéparine à la chimiothérapie avait porté le taux de réponse à la chimiothérapie à 69 %, vs 42 % pour la chimiothérapie seule, et qu’il avait contribué à prolonger la médiane de survie (13 mois vs 8 mois).
Fait digne de mention, cette étude se distingue du fait que la prolongation de la survie ne variait pas en fonction de l’étendue de la maladie. Comme l’explique le Pr Ismail Elalamy, Université Paris VI, France, la formation de caillots sanguins protègent les cellules tumorales à la fois contre le système immunitaire et les agents chimiotoxiques. En prévenant la formation de thrombi, «les HBPM facilitent l’accès de la chimiothérapie aux cellules tumorales, indique-t-il. Que le thrombus se trouve en terrain artériel ou veineux, il représente l’ennemi, de sorte que si l’HBPM est administrée le plus tôt possible dans l’évolution de la maladie, on observe une incidence moindre d’événements thrombotiques et un gain de survie.»
L’essai de phase III en cours FRAGMATIC – qui a été conçu pour reproduire la pratique clinique le plus fidèlement possible – devrait nous éclairer davantage sur les éventuels effets anticancéreux des HBPM. Les chercheurs évaluent actuellement les effets de l’ajout de la daltéparine au meilleur traitement de référence dans le cancer du poumon (tant le cancer du poumon à petites cellules que le CPNPC), tous stades confondus. Les sujets – qui reçoivent les meilleurs soins possible adaptés à leur cancer, soit la chirurgie, la radiothérapie ou un traitement symptomatique – sont randomisés de façon à recevoir de la daltéparine ou un placebo pendant 6 mois. L’essai FRAGMATIC a pour paramètre principal la survie globale et pour paramètres secondaires le taux de TEV, la qualité de vie, la toxicité et la survie sans métastase. Sur le plan de l’économie de la santé, les chercheurs tenteront aussi de déterminer si l’utilisation de l’HBPM dans ce cancer en particulier réduit le coût global pour le système de santé.
«Imaginez une seconde que l’utilisation de cette HBPM ne prolonge pas la survie, mais qu’elle réduise les coûts pour l’ensemble du système de santé. Ce serait tout de même [un résultat] très important. Le recrutement – 2203 patients au total – a pris fin en décembre 2011, et nous espérons avoir des résultats préliminaires au début de 2013.» Quant à l’hypothèse d’un éventuel gain de survie associé aux HBPM, le Dr Noble conclut en ces termes : «Il y a suffisamment d’études rigoureuses en cours, à tout le moins dans le cancer du poumon, pour que nous trouvions réponse à nos questions dans un avenir prochain.»
Questions et réponses
Les questions et les réponses qui suivent sont tirées d’un entretien avec la
Dre Agnes Lee, professeure agrégée de médecine, University of British Columbia,
et directrice du programme sur la thrombose, Vancouver General Hospital.
Q: Y aurait-il des raisons de favoriser une HBPM en particulier pour le traitement initial et le traitement à long terme de la TEV en présence d’un cancer, comme on le recommande?
R: La daltéparine est l’HBPM pour laquelle nous disposons le plus de preuves. Si vous avez le choix, il est logique de prescrire cet agent, car c’est celui dont le dossier est le mieux étoffé. C’est aussi la seule HBPM qui a été homologuée pour le traitement prolongé de la TEV en présence d’un cancer.
Q: À votre avis, se pourrait-il que les HBPM exercent des effets anticancéreux?
R: Oui, tout à fait. Cela dit, les HBPM n’agiront pas sur tous les cancers et, tout comme la chimiothérapie, elles auront peu très peu d’impact en fin de vie, lorsque le cancer est avancé. Il faut donc les administrer tôt et je pense que nous devrions cibler les cancers à risque élevé de thrombose, car l’existence d’une interaction entre l’activation de la coagulation et la croissance tumorale ne fait aucun doute.
Q: Selon vous, que doivent retenir les médecins lorsqu’ils envisagent de traiter ou de prévenir une TEV à l’aide d’une HBPM?
A: Ils doivent être à l’affût des événements thrombotiques et tenter de les prévenir. Si nous n’apprenons pas à nos patients à reconnaître les signes et les symptômes de la thrombose, nous ratons une belle occasion d’agir, et nous devrons ensuite composer avec le lourd fardeau d’un événement thrombotique. Il est donc essentiel de bien renseigner nos patients au sujet de la thrombose, car personne ne parle des complications thrombotiques éventuelles du traitement anticancéreux.