Comptes rendus
Évolution de la prise en charge de l’hypertension artérielle pulmonaire (HTAP)
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
OPTIONS MÉDICALES - Pneumologie
mars 2016
Cibler la voie de la prostacycline dans l’HTAP
Commentaire éditorial
Rédaction : Theodore Bosworth
Steeve Provencher, MD, MPH, FRCPC
Directeur, Programme d’hypertension pulmonaire
Professeur titulaire, Université Laval
Québec (Québec)
Dans le traitement de l’hypertension artérielle pulmonaire (HTAP), on attend généralement que la maladie soit parvenue à un stade avancé – typiquement la classe fonctionnelle (CF) IV – avant d’administrer un agent ciblant la voie de la prostacycline par voie intraveineuse (i.v.) ou sous-cutanée (s.c.) chez le patient recevant déjà un agent oral de première intention. Grâce à l’avènement de traitements oraux innovants qui agissent sur la voie de la prostacycline, nous pouvons maintenant cibler cette voie plus tôt dans l’évolution de la maladie. Lors de l’essai de phase III GRIPHON dont les résultats ont été publiés récemment, le selexipag, agoniste sélectif du récepteur IP qui s’administre par voie orale, a été associé à une réduction significative du risque de décès ou de complication de l’HTAP, paramètre combiné de l’étude1. Dans le présent article, il sera question des options de traitement pour l’HTAP dans le contexte des stratégies ciblant la voie de la prostacycline.
Généralités
L’hypertension pulmonaire (HP) se définit par une pression artérielle pulmonaire moyenne ≥25 mmHg au repos lors d’un cathétérisme cardiaque droit2. L’HTAP – qui se distingue des autres formes d’HP – se définit pour sa part comme une pression capillaire bloquée ≤15 mmHg et une résistance vasculaire pulmonaire >3 unités Wood en l’absence d’autres troubles sous-jacents2. Bien que l’HTAP puisse être associée à diverses étiologies, telles une connectivite, une hypertension portale et une exposition à des toxines, elle est généralement idiopathique3.
Selon toutes probabilités, les estimations de l’incidence et de la prévalence de l’HTAP sont inexactes en raison de symptômes non spécifiques qui compliquent le diagnostic de la maladie. À en juger par les statistiques européennes et américaines, le nombre de cas d’HP au Canada se situerait entre 5000 et 15 000, et l’HTAP représenterait une proportion substantielle de cas4,5. Selon l’Association d’hypertension pulmonaire du Canada, il n’est pas rare que des patients soient aux prises avec des symptômes d’HTAP depuis déjà 2 à 3 ans lorsqu’ils reçoivent finalement un diagnostic exact5. Légèrement plus fréquente chez la femme6, l’HTAP peut se manifester à tout âge, mais on a déterminé récemment aux États-Unis et en Europe que l’âge moyen au moment du diagnostic était de l’ordre de 35 à 65 ans6-8.
En phase terminale, cette maladie chronique évolue vers une insuffisance ventriculaire droite. Avant l’avènement des thérapies ciblées pour l’HTAP, la médiane de survie post-diagnostic était inférieure à 3 ans9. On a enregistré des gains de survie après l’arrivée sur le marché de meilleures options de traitement et l’amélioration du processus diagnostique, si bien que les taux de survie à 5 ans excèdent maintenant 50 %10. Les efforts que l’on déploie pour amorcer et optimiser le traitement aux premiers stades de l’HTAP pourraient nous permettre de ralentir la progression de la maladie et, en définitive, de prolonger la survie11. Pour atteindre ce but, nous devons faire l’impossible afin que les patients demeurent à faible risque et qu’ils conservent une capacité fonctionnelle optimale.
Voie de la prostacycline
Libérée par les cellules endothéliales, la prostacycline (PGI2) est l’un des cinq prostanoïdes d’origine naturelle. Médiateur clé de systèmes interactifs qui contribuent étroitement à la progression de l’HTAP, la prostacycline exerce ses effets biologiques par l’intermédiaire de récepteurs membranaires à la surface de la cellule12. Contrairement à certains prostanoïdes, comme la PGE2, qui active à la fois le récepteur EP1 associé à l’activité contractile et les récepteurs EP2 et EP4 associés à l’activité de relaxation, la PGI2 active uniquement le récepteur IP (Figure 1). Associé à la vasorelaxation, ce récepteur est situé sur les cellules musculaires lisses vasculaires de même que sur les cellules épithéliales, les fibroblastes et les plaquettes. Lorsqu’il est activé, non seulement entraîne-t-il une régulation positive de l’AMPc – qui contribue à la vasorelaxation –, mais il déclenche en aval une cascade de signalisation qui exerce des effets antiprolifératifs et anti-inflammatoires et qui inhibe l’agrégation plaquettaire13.
Figure 1.
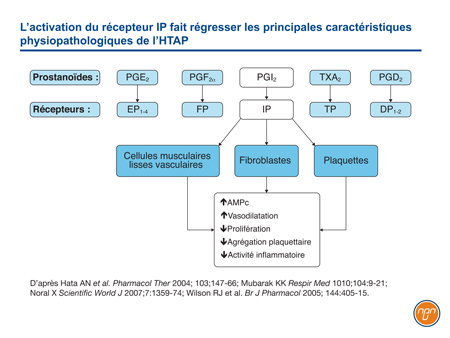
L’HTAP se caractérise à la fois par de faibles taux de prostacycline endogène et par la suppression de l’activité de la prostacycline14, ce qui renforce l’avantage escompté d’une activation de cette voie par l’époprosténol, les analogues de la prostacycline ou des thérapies innovantes agissant directement sur les récepteurs de la prostacycline.
L’époprosténol i.v., une prostacycline synthétique, est devenu le premier traitement spécifique de l’HTAP lorsqu’il a été homologué vers le milieu des années 1990. Des chercheurs se sont intéressés à la voie de la prostacycline en tant que cible du traitement de l’HTAP à la suite d’une série d’études expérimentales menées lorsque les prostanoïdes ont été isolés en 197615. Ces études ont débouché sur une étude clinique multicentrique majeure ayant associé l’époprosténol à une prolongation de la survie (p=0,003) comparativement au traitement standard chez des patients atteints d’HTAP de CF III ou IV16.
Bien que ces traitements agissant sur la prostacycline soient efficaces contre l’HTAP, on continue de les utiliser principalement chez les patients dont la maladie est avancée, en grande partie à cause des préparations actuellement sur le marché. L’époprosténol ayant une demi-vie de quelques minutes17, il ne peut être administré qu’en perfusion continue. Le tréprostinil, dont l’efficacité se compare à celle de l’époprosténol18, est offert en préparations i.v. et s.c., mais l’administration s.c. à l’aide d’une pompe à perfusion portable est somme toute peu pratique. De plus, des douleurs au point de perfusion surviennent chez environ 80 % des patients19.
C’est en raison du développement d’agents oraux inhibant la vasoconstriction médiée par l’endothéline ou favorisant la vasodilatation médiée par le monoxyde d’azote (NO) que les traitements agissant sur la voie de la prostacycline ont dans les faits été relégués au traitement de la maladie avancée. Des analogues de la prostacycline oraux et en inhalation comme le tréprostinil, l’iloprost et le béraprost ont été mis au point, mais leur efficacité s’est révélée mitigée. Lors de l’essai TRIUMPH, 235 patients atteints d’HTAP de CF III ou IV déjà sous bosentan ou sildénafil ont été randomisés de façon à recevoir du tréprostinil en inhalation ou un placebo20. À 12 semaines, la distance parcourue au test de marche de 6 minutes (dTM6M), la qualité de vie et le taux de NT-proBNP s’étaient tous améliorés sous tréprostinil, comparativement au placebo. En revanche, le tréprostinil oral n’a pas permis d’obtenir d’amélioration significative de la dTM6M comparativement au placebo lorsqu’il était ajouté à un traitement de fond stable par un antagoniste de l’endothéline (ARE) ou un inhibiteur de la phosophodiestérase de type 5 (PDE5), ni dans l’étude FREEDOM-C ni dans l’étude FREEDOM-C221,22. Dans le cadre d’une évaluation prospective et non comparative à long terme, l’iloprost en inhalation a réussi à stabiliser l’HTAP chez seulement une minorité de patients23.
Au Canada, l’époprosténol i.v. ainsi que le tréprostinil i.v. et s.c. sont les seules options de traitement de l’HTAP qui agissent sur la voie de la prostacycline. Au nombre des agents ciblant les deux autres voies accessibles, on compte trois ARE, deux inhibiteurs de la PDE5, et un inhibiteur de la guanylate cyclase soluble (GCs) qui, comme les inhibiteurs de la PDE5, cible la voie du NO. Les agents oraux étant commodes, le traitement de première intention repose presque toujours sur un agent oral. Il est fréquent de combiner plusieurs agents oraux avant que l’HTAP soit considérée comme suffisamment avancée pour que l’on envisage un traitement i.v. ou s.c. ciblant la voie de la prostacycline.
Nouvelles stratégies axées sur la voie de la prostacycline
Nous avons fait des progrès : nous pouvons maintenant cibler la voie de la prostacycline à l’aide d’agents oraux qui modulent l’activité des récepteurs de la prostacycline. Ces agents oraux permettent d’avoir recours à ce mode d’action beaucoup plus tôt dans la progression de la maladie. Qu’ils soient utilisés seuls ou en association avec d’autres traitements oraux, les agents capables de favoriser les effets vasodilatateurs de la prostacycline à un stade précoce de la maladie pourraient s’inscrire dans les efforts actuels que l’on déploie pour ralentir la progression de la physiopathologie sous-jacente.
Seul récepteur de la prostacycline à effet relaxant exprimé dans les artères pulmonaires24, le récepteur IP est une cible logique et appropriée dans le développement de médicaments25. IP est le principal récepteur activé par la PG12. Contrairement à plusieurs autres sous-types de récepteurs qui exercent des effets variables sur la vasodilatation et/ou la prolifération des cellules musculaires lisses, le récepteur IP contribue étroitement à la médiation des effets vasodilatateurs et antiprolifératifs26. Contrairement aux antagonistes sélectifs du récepteur IP, les analogues de la prostaglandine, comme l’iloprost et le tréprostinil, se caractérisent par une affinité variable pour divers récepteurs de prostanoïdes et, par conséquent, une activité variable qui, dans certains cas, pourrait être contre-productive dans le traitement de l’HTAP13.
Le selexipag est le premier agoniste sélectif oral du récepteur IP de la prostacycline à atteindre un stade avancé du développement27. Lors d’essais précliniques, le selexipag s’est caractérisé par une grande affinité pour le récepteur IP28, lequel régit les effets vasodilatateurs de la voie de la prostacycline, mais aussi par une faible affinité pour d’autres récepteurs de la prostacycline. Une étude de phase II de validation de principe a confirmé un effet vasodilatateur plutôt léger, mais significatif que l’on pourrait qualifier de compatible avec l’activité observée dans les études expérimentales27. L’essai de phase II a aussi permis de confirmer que le médicament était bien toléré et qu’il se prêtait à un développement plus poussé.
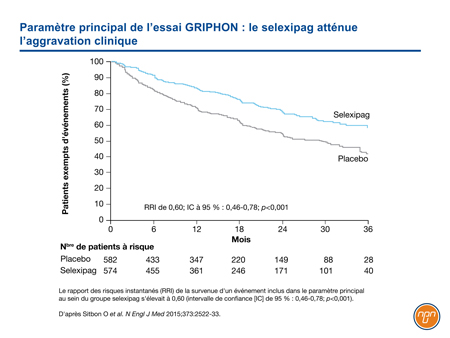
Dans l’essai de phase III intitulé GRIPHON1, 1156 patients atteints d’HTAP ont été randomisés de façon à recevoir du selexipag ou un placebo. Les patients qui recevaient un traitement de fond stable par un ARE ou un inhibiteur de la PDE5, ou les deux, y étaient admissibles. Parmi les patients admis à l’essai, 20 % n’avaient jamais été traités, 47 % recevaient l’un de ces agents oraux et 33 % recevaient un agent des deux catégories. Le paramètre principal était constitué du décès toutes causes confondues et d’une complication de l’HTAP pendant le traitement. Par «complication», on entendait la progression de la maladie (diminution >15 % de la dTM6M par rapport à la dTM6M initiale, accompagnée soit d’une aggravation de la CF de l’OMS, soit du recours obligatoire à un traitement supplémentaire pour l’HTAP) ou encore, une aggravation de l’HTAP qui entraînait l’hospitalisation, l’instauration d’un traitement parentéral par un prostanoïde ou d’une oxygénothérapie à long terme, ou le recours obligatoire à une transplantation pulmonaire ou à une septostomie auriculaire par ballonnet.
Le risque d’événement inclus dans le paramètre principal a diminué de 40 % dans le groupe selexipag, comparativement au groupe placebo (rapport des risques instantanés [RRI] de 0,60; IC à 95 % : 0,46-0,78; p<0,001) (Figure 2). L’effet du traitement est demeuré constant dans tous les sous-groupes (âge, sexe, CF initiale et traitement de fond). Le profil d’innocuité était compatible avec celui des autres agents ciblant la voie de la prostacycline. Les effets indésirables les plus fréquents étaient les myalgies, les bouffées vasomotrices, les céphalées, la diarrhée et les douleurs aux mâchoires.
Figure 2.
Les résultats de l’essai GRIPHON – qui confirment l’avantage clinique associé à un agent oral ciblant la voie de la prostacycline – ont déjà été pris en compte dans les recommandations conjointes de l’ESC/ERS de 2015 (European Society of Cardiology/European Respiratory Society); l’ajout du selexipag à un ARE, à un inhibiteur de la PDE5 ou aux deux dans le cadre d’un traitement séquentiel a en effet reçu une recommandation de niveau I11. Cet aval s’inscrit dans une recommandation plus générale pour que l’HTAP demeure à faible risque, de CF II dans la mesure du possible. L’actualisation de ces recommandations dans le traitement de l’HTAP témoigne d’une réorientation vers l’amélioration des résultats à long terme qui vient se greffer à l’objectif immédiat d’une meilleure qualité de vie.
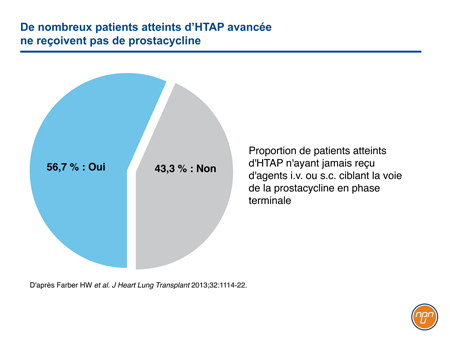
Bien que la voie de la prostacycline ait été la première à générer des résultats favorables dans le traitement de l’HTAP, l’avènement d’agents oraux ciblant efficacement les voies de l’endothéline et du NO a éclipsé son rôle. Il importe ici de souligner que les prostanoïdes i.v. demeurent le traitement de choix chez les patients à risque élevé, notamment ceux de CF IV11. Cependant, même en présence d’une maladie avancée, les traitements agissant sur la voie de la prostacycline semblent sous-utilisés. Dans un registre de l’HTAP où l’on tente de cerner les habitudes de pratique aux États-Unis, seulement 56,7 % des patients avaient reçu de la prostacycline ou un analogue de la prostacycline par voie i.v. ou s.c. au cours des 6 mois précédant leur décès (Figure 3)29. L’avènement d’agents oraux ciblant la voie de la prostacycline a d’importantes retombées, l’arsenal de traitement de l’HTAP s’en trouvant élargi. Chez les patients atteints d’HTAP, les taux de morbidité à long terme et de mortalité demeurent élevés, certes, mais l’essai GRIPHON a confirmé que le traitement au long cours par un agoniste sélectif du récepteur IP administré par voie orale qui agit sur la voie de la prostacycline était associé à un risque moindre de complications de la maladie.
Figure 3.
Conclusion
À en juger par les données du registre, la survie des patients atteints d’HTAP est plus longue grâce aux traitements maintenant administrés plus tôt et en association qui ralentissent la progression de la maladie30. Les associations reposent principalement sur les ARE et les inhibiteurs de la PDE5 oraux. En objectivant une protection contre l’aggravation clinique, l’essai GRIPHON a étayé la théorie voulant que l’on obtienne de meilleurs résultats en instaurant un traitement agissant sur la voie de la prostacycline à un stade assez précoce de la maladie. Les effets du selexipag semblent indépendants et s’ajoutent à ceux des traitements oraux ciblant les voies de l’endothéline et du NO qui régissent aussi la progression de l’HTAP.
Références
1. Sitbon O, Channick R, Chin KM et al. Selexipag for the Treatment of Pulmonary Arterial Hypertension. N Engl J Med 2015;373:2522-33.
2. Hoeper MM, Bogaard HJ, Condliffe R et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol 2013;62:D42-50.
3. Farber HW, Loscalzo J. Pulmonary arterial hypertension. N Engl J Med 2004;351:1655-65.
4. Mehta SR. Living with PH. http://www.livingwithphca/landinghtm;1er décembre 2015.
5. PHC. Association d’hypertension pulmonaire du Canada, 2015.
6. Badesch DB, Raskob GE, Elliott CG et al. Pulmonary arterial hypertension: baseline characteristics from the REVEAL Registry. Chest 2010;137:376-87.
7. Frost AE, Badesch DB, Barst RJ et al. The changing picture of patients with pulmonary arterial hypertension in the United States: how REVEAL differs from historic and non-US Contemporary Registries. Chest 2011;139:128-37.
8. Humbert M, Sitbon O, Chaouat A et al. Pulmonary arterial hypertension in France: results from a national registry. Am J Respir Crit Care Med 2006;173:1023-30.
9. Sandoval J, Bauerle O, Palomar A et al. Survival in primary pulmonary hypertension. Validation of a prognostic equation. Circulation 1994;89:1733-44.
10. Benza RL, Miller DP, Barst RJ et al. An evaluation of long-term survival from time of diagnosis in pulmonary arterial hypertension from the REVEAL Registry. Chest 2012;142:448-56.
11. "2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS)." Nazzareno Galie, Marc Humbert, Jean-Luc Vachiery, et al. Eur Respir J 2015; 46: 903-975. Eur Respir J 2015;46:1855-6.
12. Zhang L, Huang G, Wu J et al. A profile of the residues in the first intracellular loop critical for Gs-mediated signaling of human prostacyclin receptor characterized by an integrative approach of NMR-experiment and mutagenesis. Biochemistry 2005;44:11389-401.13.
13. Whittle BJ, Silverstein AM, Mottola DM et al. Binding and activity of the prostacyclin receptor (IP) agonists, treprostinil and iloprost, at human prostanoid receptors: treprostinil is a potent DP1 and EP2 agonist. Biochem Pharmacol 2012;84:68-75.
14. Christman BW, McPherson CD, Newman JH et al. An imbalance between the excretion of thromboxane and prostacyclin metabolites in pulmonary hypertension. N Engl J Med 1992;327:70-5.
15. Moncada S, Gryglewski R, Bunting S et al. An enzyme isolated from arteries transforms prostaglandin endoperoxides to an unstable substance that inhibits platelet aggregation. Nature 1976;263:663-5.
16. Barst RJ, Rubin LJ, Long WA, et al. A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. N Engl J Med 1996;334:296-301.
17. Safdar Z. Treatment of pulmonary arterial hypertension: the role of prostacyclin and prostaglandin analogs. Respir Med 2011;105:818-27.
18. McLaughlin VV, Gaine SP, Barst RJ et al. Efficacy and safety of treprostinil: an epoprostenol analog for primary pulmonary hypertension. Journal Cardiovasc Pharmacol 2003;41:293-9.
19. Skoro-Sajer N, Lang I, Naeije R. Treprostinil for pulmonary hypertension. Vasc Health Risk Manag 2008;4:507-13.
20. McLaughlin VV, Benza RL, Rubin LJ et al. Addition of inhaled treprostinil to oral therapy for pulmonary arterial hypertension: a randomized controlled clinical trial. J Am Coll Cardiol 2010;55:1915-22.
21. Tapson VF, Torres F, Kermeen F et al. Oral treprostinil for the treatment of pulmonary arterial hypertension in patients on background endothelin receptor antagonist and/or phosphodiesterase type 5 inhibitor therapy (the FREEDOM-C study): A randomized controlled trial. Chest 2012;142:1383-90.
22. Tapson VF, Jing ZC, Xu KF et al. Oral treprostinil for the treatment of pulmonary arterial hypertension in patients receiving background endothelin receptor antagonist and phosphodiesterase type 5 inhibitor therapy (the FREEDOM-C2 study): a randomized controlled trial. Chest 2013;144:952-8.
23. Opitz CF, Wensel R, Winkler J et al. Clinical efficacy and survival with first-line inhaled iloprost therapy in patients with idiopathic pulmonary arterial hypertension. Eur Heart J 2005;26:1895-902.
24. Wilson RJ, Giles H. Piglet saphenous vein contains multiple relaxatory prostanoid receptors: evidence for EP4, EP2, DP and IP receptor subtypes. Br J Pharmacol 2005;144:405-15.
25. Galie N, Ghofrani AH. New horizons in pulmonary arterial hypertension therapies. Eur Respir Rev 2013;22:503-14.
26 Norel X. Prostanoid receptors in the human vascular wall. ScientificWorldJournal 2007;7:1359-74.
27. Simonneau G, Torbicki A, Hoeper MM et al. Selexipag: an oral, selective prostacyclin receptor agonist for the treatment of pulmonary arterial hypertension. Eur Respir J 2012;40:874-80.
28. Asaki T, Kuwano K, Morrison K et al. Selexipag: An Oral and Selective IP Prostacyclin Receptor Agonist for the Treatment of Pulmonary Arterial Hypertension. J Med Chem 2015;58:7128-37.
29. Farber HW, Miller DP, Meltzer LA et al. Treatment of patients with pulmonary arterial hypertension at the time of death or deterioration to functional class IV: insights from the REVEAL Registry. J Heart and Lung Transplant 2013;32:1114-22.
30. Pauwaa S, Machado RF, Desai AA. Survival in pulmonary arterial hypertension: A brief review of registry data. Pulmonary Circulation 2011;1:430-1.
Traitement d’association : stratégie pour retarder la progression de l’HTAP
Commentaire éditorial
Rédaction : Theodore Bosworth
John Swiston, MD, MPH, FRCPC
Division de pneumologie
University of British Columbia
Vancouver (Colombie-Britannique)
L’hypertension artérielle pulmonaire (HTAP) étant incurable, l’objectif du traitement est de ralentir la progression de la maladie. Vu le nombre croissant d’agents efficaces en monothérapie, il devient logique d’associer des agents dotés de modes d’action différents. D’abord empirique, cette pratique est maintenant étayée par de nombreuses preuves de protection contre les événements cliniques liés à l’HTAP comparativement à un agent seul. Au nombre de ces preuves figurent les résultats de plusieurs essais sur l’ajout d’une nouvelle option de traitement au traitement en cours ainsi que les résultats d’un essai où l’on a comparé deux agents individuels à l’association des deux. Ces essais n’ont pas encore permis d’établir que le recours précoce au traitement d’association infléchissait le cours naturel de l’HTAP, mais il a été démontré que l’on obtenait de meilleurs résultats en bloquant la progression de la classe fonctionnelle (CF). Selon les recommandations actuelles, le traitement d’association est une stratégie appropriée; qui plus est, les données d’un registre montrent que la majorité des patients atteints d’HTAP reçoivent maintenant au moins deux traitements.
Généralités
Le traitement de l’HTAP cible trois voies moléculaires majeures (Figure 1). Chacune de ces voies – la prostacycline, l’endothéline et le monoxyde d’azote (NO) – est impliquée dans les cascades de signalisation qui modulent le déséquilibre vasoconstriction/vasodilatation, la prolifération des cellules vasculaires et l’inflammation caractérisant la progression de l’HTAP. Chacune est associée à un avantage clinique lorsqu’elle est ciblée indépendamment, mais le bénéfice peut être additif lorsque deux voies ou les trois voies sont ciblées simultanément.
Figure 1.
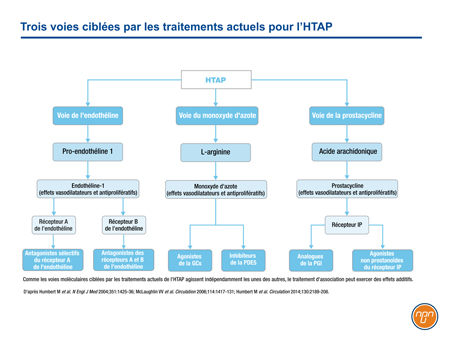
La voie de la prostacycline a été la première des trois à être ciblée par un médicament. L’activité de la prostacycline – puissant vasodilatateur endogène libéré par les cellules endothéliales – est altérée dans l’HTAP1. Les récepteurs activés dans la circulation pulmonaire, tels les récepteurs situés sur les cellules musculaires lisses, donnent lieu à des signaux à l’origine de la vasorelaxation et d’effets antiprolifératifs et anti-inflammatoires2. Le premier agent ciblant la voie de la prostacycline qui ait été homologué, l’époprosténol administré par voie intraveineuse (i.v.), avait amélioré significativement la distance parcourue au test de marche de 6 minutes (dTM6M) à 12 semaines chez des patients atteints d’HTAP de CF III ou IV3. D’autres agents ciblant la voie de la prostacycline ont ensuite été homologués.
La voie de l’endothéline a été la deuxième à être associée à des résultats favorables dans le traitement de l’HTAP. L’endothéline (ET-1) est un puissant vasoconstricteur qui déclenche une signalisation essentielle au remodelage interstitiel caractéristique de l’HTAP4. Il a été démontré que le taux d’ET-1 était plus élevé en présence d’HTAP qu’en présence d’une fonction pulmonaire normale5. Le premier antagoniste des récepteurs de l’endothéline (ARE) homologué pour le traitement de l’HTAP, le bosentan, a lui aussi permis d’améliorer significativement la dTM6M comparativement au placebo6. Des études subséquentes ont donné lieu à l’homologation de l’ambrisentan, après quoi une étude de plus longue durée axée sur un paramètre plus rigoureux qui regroupait la morbidité et la mortalité a conduit à l’homologation du macitentan7,8.
Dans la troisième voie, on stimule la vasodilatation médiée par le monoxyde d’azote (NO). Le sildénafil, le premier agent ciblant cette voie qui ait été homologué pour le traitement de l’HTAP, inhibe la phosphodiestérase de type 5 (PDE5), enzyme qui dégrade et désactive le second messager, le guanosine monophosphate cyclique (GMPc)9. Dans l’essai pivot de phase III, le sildénafil avait amélioré la dTM6M à 12 semaines comparativement au placebo10. Le tadalafil, autre inhibiteur de la PDE5 pour le traitement de l’HTAP, a également été associé à des gains durables de dTM6M11. Le riociguat, le plus récent agent ciblant la voie du NO qui ait été homologué, stimule directement la guanosine cyclase soluble (GCs), ce qui entraîne une production accrue de GMPc12. Cet agent était lui aussi associé à une amélioration de la dTM6M après 16 semaines de traitement13.
Si l’objectif initial du traitement était d’améliorer l’issue fonctionnelle à court terme, on aspire maintenant à l’améliorer à long terme, comme en témoignent les paramètres d’évaluation des essais en cours. Les trois voies ciblées par le traitement de l’HTAP sont liées à l’inhibition de la cascade sous-jacente des événements physiopathologiques, notamment l’inflammation, la fibrose et le remodelage vasculaire14-16. Le diagnostic plus précoce de l’HTAP et le blocage plus intensif de ces événements pourraient expliquer, du moins en partie, les gains de survie obtenus chez les patients atteints d’HTAP, la survie étant passée d’environ 3 ans en 1990 avant l’avènement d’un traitement spécifique de l’HTAP à 7 ans en 201217.
Traitement d’association
L’association de traitements ciblant différentes voies de l’HTAP relève de l’intuition. Même si les petites études sur le traitement d’association n’ont pas toutes fait ressortir un avantage significatif lié à l’ajout d’un deuxième agent à la monothérapie18, plusieurs études plus vastes, comme PACES19 – qui a mis en évidence une prolongation du délai d’aggravation clinique sous l’effet de l’ajout du sildénafil oral, comparativement à l’époprosténol i.v. seul – étayent cette approche20. Les auteurs d’une méta-analyse publiée en 2012 ont conclu que les associations amélioraient à la fois le profil hémodynamique et les résultats cliniques21. Au moment où les résultats de cette méta-analyse ont été diffusés, l’analyse d’un registre d’envergure sur l’HTAP aux États-Unis a révélé que près de la moitié des patients atteints d’HTAP recevaient deux médicaments et que près de 10 % en recevaient trois22.
De récents essais cliniques sur l’HTAP ont permis de recueillir pas mal de données montrant que le traitement d’association est approprié chez les patients ne répondant pas adéquatement à un seul médicament. Au nombre de ces essais figurent non seulement des essais conçus expressément pour évaluer une association, mais aussi des essais qui visent à comparer un nouvel agent avec un placebo chez des patients déjà sous traitement. La comparaison d’un agent expérimental à un placebo chez des patients qui poursuivent leur traitement en cours permet également d’évaluer un traitement d’association.
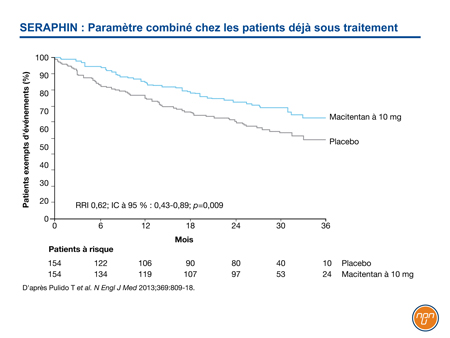
Lors de l’essai SERAPHIN, par exemple, 64 % des patients admis ont poursuivi leur traitement de fond, le plus souvent un inhibiteur de la PDE58. Malgré la vaste proportion de patients recevant un agent actif, la dose de 10 mg de macitentan a été associée à une diminution de 45 % (RRI 0,55; IC à 95 % : 0,39-0,76; p<0,001) du risque de décès, de septostomie auriculaire, de transplantation pulmonaire, d’instauration d’un traitement par un prostanoïde i.v. ou s.c. ou d’aggravation de l’HTAP – autant d’éléments du paramètre combiné – comparativement au placebo. Dans le groupe des patients qui recevaient déjà un traitement, la diminution de 38 % du risque d’événement formant le paramètre combiné est demeurée statistiquement significative (RRI 0,62; IC à 95 % : 0,43-0,89; p=0,009) (Figure 2).
Figure 2.
Dans l’étude PATENT-1 sur le riociguat, agoniste de la GCs, environ 50 % des sujets recevaient déjà un traitement actif, principalement un ARE23. Le paramètre principal était la variation de la dTM6M à 12 semaines. Cette étude est peut-être la dernière d’envergure sur l’HTAP à ne pas inclure la morbidité et la mortalité dans le paramètre principal, mais elle a tout de même fait ressortir la supériorité de l’agent évalué sur le placebo quant à la dTM6M malgré la proportion substantielle de sujets recevant un traitement actif.
L’étude GRIPHON – qui vient de se terminer et qui est la plus vaste jamais menée sur l’HTAP – avait pour objectif d’évaluer le selexipag, agoniste sélectif du récepteur de la prostacycline IP, chez 1156 patients24. Dans cet essai comparatif avec placebo, seulement 20 % des sujets n’avaient jamais été traités; près de 50 % recevaient soit un inhibiteur de la PDE5, soit un ARE, alors que 33 % recevaient les deux en concomitance. Malgré la proportion élevée de patients qui recevaient jusqu’à deux agents actifs, l’ajout du selexipag a été associé à une diminution de 40 % (RRI 0,60; IC à 95 % : 0,46-0,78; p<0,001) de la morbidité et de la mortalité. Ces résultats concordent avec ceux d’une petite étude dans laquelle une trithérapie – chacun des éléments ciblant une voie distincte de l’HTAP – a été associée à des gains à long terme en présence d’une HTAP avancée25, mais GRIPHON est le premier essai prospectif d’envergure à tester cette stratégie. De plus, l’efficacité d’un traitement ciblant les trois voies a été observée chez des patients à un stade plus précoce de l’HTAP. Parmi les patients randomisés, 44 % présentaient une HTAP de CF II au moment de leur admission.
L’essai AMBITION – qui a été conçu expressément pour comparer une association à une monothérapie en première intention26 – a aussi pris fin récemment. Seuls des patients jamais traités y étaient admissibles. Comme les essais SERAPHIN et GRIPHON, AMBITION reposait sur un paramètre principal combiné incluant la morbidité et la mortalité. Les patients étaient randomisés de façon à recevoir de l’ambrisentan et un placebo, du tadalafil et un placebo, ou les deux agents actifs en association. Chez les patients recevant l’association, comparativement à ceux qui recevaient un seul agent actif, on a observé une diminution de 50 % de la morbidité et de la mortalité (RRI 0,50; IC à 95 % : 0,35-0,72; p<0,001).
Dans l’ensemble, les essais récents ont généré un volume considérable de données montrant que le traitement d’association améliore les résultats en présence d’HTAP. Même si les preuves à l’appui d’un gain résultant de l’administration d’un deuxième agent chez des patients déjà sous traitement sont indirectes, la protection contre l’aggravation clinique chez des patients déjà sous traitement actif est compatible avec le gain auquel on s’attendrait en ciblant deux voies au lieu d’une seule.
Comparativement à la seule amélioration fonctionnelle à court terme, les paramètres combinés regroupant la morbidité et la mortalité auxquels on a recours dans les essais cliniques d’envergure ont réorienté l’objectif du traitement de l’HTAP vers l’issue fonctionnelle à long terme. Tirant profit des résultats des essais SERAPHIN et AMBITION qui ont objectivé l’utilité du traitement d’association, GRIPHON a été le premier essai comparatif avec randomisation à inclure une proportion substantielle de patients sous trithérapie. Ces données soulignent l’utilité de cibler plusieurs voies thérapeutiques assez tôt dans le processus morbide dans le but d’améliorer les résultats cliniques.
Le rôle des associations dans les recommandations officielles
Dans leurs recommandations conjointes de 2015, l’ESC (European Society of Cardiology) et l’ERC (European Respiratory Society) acceptent le recours aux associations, voire à la trithérapie, dans le but de maintenir l’HTAP en CF II ou de la ramener en CF II27. Dans leurs recommandations conjointes antérieures, l’ESC et l’ERS avalisaient déjà le traitement d’association au nombre des solutions acceptables en présence d’une HTAP en progression, mais c’est la première fois que cette solution est étayée par des données probantes. En effet, dans les recommandations de 2015, l’ESC et l’ERS recommandent le traitement d’association même chez les patients atteints d’HTAP de CF II lorsqu’il est essentiel de maintenir le patient à faible risque. À la lumière des études publiées, trois stratégies d’association séquentielle sont appuyées par des données probantes de niveau I.
Dans le cadre d’une méta-analyse citée dans les recommandations conjointes de l’ESC/ERS, le traitement d’association a permis une diminution relative de 52 % (RR 0,48; IC à 95 % : 0,26-0,91; p=0,023) du risque d’aggravation clinique comparativement au traitement de référence sans pour autant accroître le taux d’effets indésirables graves15.
Considérant comme appropriés le recours au traitement d’association dès le départ et le recours aux traitements séquentiels, l’ESC et l’ERS reconnaissent l’importance de combiner les modes d’action lorsqu’un seul traitement ne permet pas d’atteindre les objectifs (Figure 3). Les trois associations séquentielles suivantes ont reçu une recommandation de niveau I en présence d’HTAP de CF II : macitentan + sildénafil, selexipag + un ARE et/ou un inhibiteur de la PDE5, ainsi que riociguat + bosentan. En présence d’une HTAP de CF III, ces mêmes associations ainsi que l’association sildénafil + époprosténol sont étayées par des données de niveau I. L’essai GRIPHON sur le selexipag est celui qui a généré les meilleures données prospectives montrant l’avantage de cibler simultanément les trois voies que l’on sait impliquées dans l’HTAP.
Figure 3.

Les résultats sont meilleurs lorsqu’on empêche l’HTAP d’évoluer vers une CF supérieure28. Certes, l’ESC et l’ERS reconnaissaient les gains potentiels du traitement d’association dans la version antérieure de leurs recommandations, mais elles font maintenant état de données probantes à l’appui de cette stratégie. L’ESC et l’ERS estiment que la décision d’ajouter un ou plusieurs agents dans le traitement de l’HTAP pourrait être raisonnable même lorsque l’HTAP est stable ou qu’elle a régressé légèrement, mais qu’elle n’a pas encore atteint les objectifs du traitement, la régression de la CF par exemple.
Conclusion
Dans leurs recommandations conjointes actuelles, l’ESC et l’ERS préconisent le recours à un traitement d’association afin de maintenir le patient à faible risque. Cette recommandation s’appuie sur de multiples essais ayant montré qu’il est bénéfique de cibler simultanément plusieurs voies distinctes. Dans les recommandations, il est précisé que l’on peut déjà cibler les trois voies en présence d’une CF II pour maintenir un faible risque et que cette stratégie donne lieu à un meilleur pronostic. Étayée par les résultats récents de l’essai GRIPHON, cette recommandation particulière témoigne de l’évolution du traitement de l’HTAP : de la monothérapie, nous sommes passés à la bithérapie, puis à la trithérapie, l’objectif étant toujours de ralentir la progression de la maladie, même lorsqu’elle est peu avancée.
Références
1. Tuder RM, Cool CD, Geraci MW et al. Prostacyclin synthase expression is decreased in lungs from patients with severe pulmonary hypertension. Am J Respir Crit Care Med 1999;159:1925-32.
2. Mubarak KK. A review of prostaglandin analogs in the management of patients with pulmonary arterial hypertension. Respir Med 2010;104:9-21.
3. Barst RJ, Rubin LJ, Long WA et al. A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. N Engl J Med 1996;334:296-301.
4. Dupuis J, Hoeper MM. Endothelin recepotr antagonists in pulmonary arterial hypertension. Eur J Respir 2008;31:407-15.
5. Rubens C, Ewert R, Halank M et al. Big endothelin-1 and endothelin-1 plasma levels are correlated with the severity of primary pulmonary hypertension. Chest 2001;120:1562-9.
6. Rubin LJ, Badesch DB, Barst RJ et al. Bosentan therapy for pulmonary arterial hypertension. N Engl J Med 2002;346:896-903.
7. Galie N, Olschewski H, Oudiz RJ et al. Ambrisentan for the treatment of pulmonary arterial hypertension: results of the ambrisentan in pulmonary arterial hypertension, randomized, double-blind, placebo-controlled, multicenter, efficacy (ARIES) study 1 and 2. Circulation 2008;117:3010-9.
8. Pulido T, Adzerikho I, Channick RN et al. Macitentan and morbidity and mortality in pulmonary arterial hypertension. N Engl J Med 2013;369:809-18.
9. Barnett CF, Machado RF. Sildenafil in the treatment of pulmonary hypertension. Vasc Health Risk Manag 2006;2:411-22.
10. Galie N, Ghofrani HA, Torbicki A et al. Sildenafil citrate therapy for pulmonary arterial hypertension. N Engl J Med 2005;353:2148-57.
11. Oudiz RJ, Brundage BH, Galie N et al. Tadalafil for the treatment of pulmonary arterial hypertension: a double-blind 52-week uncontrolled extension study. J Am Coll Cardiol 2012;60:768-74.
12. Grimminger F, Weimann G, Frey R et al. First acute haemodynamic study of soluble guanylate cyclase stimulator riociguat in pulmonary hypertension. Eur Respir J 2009;33:785-92.
13. Ghofrani HA, D’Armini AM, Grimminger F et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension. N Engl J Med 2013;369:319-29.
14. Fukumoto Y, Shimokawa H. Recent progress in the management of pulmonary hypertension. Circ J 2011;75:1801-10.
15. Galie N, Palazzini M, Manes A. Pulmonary arterial hypertension: from the kingdom of the near-dead to multiple clinical trial meta-analyses. Eur Heart J 2010;31:2080-6.
16. Archer SL, Weir EK, Wilkins MR. Basic science of pulmonary arterial hypertension for clinicians: new concepts and experimental therapies. Circulation 2010;121:2045-66.
17. Benza RL, Miller DP, Barst RJ et al. An evaluation of long-term survival from time of diagnosis in pulmonary arterial hypertension from the REVEAL Registry. Chest 2012;142:448-56.
18. Ruiz G, Besinque GM, Lickert CA et al. Combination therapy in pulmonary arterial hypertension: is this the new standard of care? Am J Manag Care 2015;21:s151-61.
19. Simonneau G, Rubin LJ, Galie N et al. Addition of sildenafil to long-term intravenous epoprostenol therapy in patients with pulmonary arterial hypertension: a randomized trial. Ann Intern Med 2008;149:521-30.
20. Ghofrani HA, Humbert M. The role of combination therapy in managing pulmonary arterial hypertension. Eur Respir Rev 2014;23:469-75.
21. Zhu B, Wang L, Sun L et al. Combination therapy improves exercise capacity and reduces risk of clinical worsening in patients with pulmonary arterial hypertension: a meta-analysis. J Cardiovasc Pharmacol 2012;60:342-6.
22. McGoon MD, Miller DP. REVEAL: A contemporary US pulmonary arterial hypertension registry. Eur Respir Rev 2012;21:8-18.
23. Ghofrani HA, Galie N, Grimminger F et al. Riociguat for the treatment of pulmonary arterial hypertension. N Engl J Med 2013;369:330-40.
24. Sitbon O, Channick R, Chin KM et al. Selexipag for the Treatment of Pulmonary Arterial Hypertension. N Engl J Med 2015;373:2522-33.
25. Sitbon O, Jais X, Savale L et al. Upfront triple combination therapy in pulmonary arterial hypertension: a pilot study. Eur Respir J 2014;43:1691-7.
26. Galie N, Barbera JA, Frost AE et al. Initial Use of Ambrisentan plus Tadalafil in Pulmonary Arterial Hypertension. N Engl J Med 2015;373:834-44.
27. "2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS)." Nazzareno Galie, Marc Humbert, Jean-Luc Vachiery et al. Eur Respir J 2015; 46: 903-975. Eur Respir J 2015;46:1855-6.
28. Nickel N, Golpon H, Greer M et al. The prognostic impact of follow-up assessments in patients with idiopathic pulmonary arterial hypertension. Eur Respir J 2012;39:589-96.
Atteindre les objectifs à long terme du traitement de l’HTAP
Commentaire éditorial
Rédaction : Theodore Bosworth
Ali M. Kapasi, MD, FRCPC
Division de pneumologie
University of Alberta
Edmonton (Alberta)
Une physiopathologie complexe – vasoconstriction, prolifération cellulaire, fibrose et thrombose in situ – sous-tend l’hypertension artérielle pulmonaire (HTAP). Les déficits hémodynamiques évolutifs qui résultent de ce processus se soldent par une insuffisance cardiaque droite. Lors des premières études sur l’HTAP, on évaluait l’efficacité d’un traitement à la lumière de l’amélioration de la capacité fonctionnelle qu’il permettait à court terme, par exemple en mesurant la variation de la distance parcourue au test de marche de 6 minutes (dTM6M) sur une période de 3 ou 4 mois. Au fil de l’évolution du domaine et de l’élargissement de l’arsenal thérapeutique, les chercheurs se sont tournés vers l’atténuation de la progression de la maladie à long terme. Ce changement d’orientation s’est reflété dans le choix des paramètres d’évaluation lors d’essais cliniques récents. À l’heure actuelle, on tente d’évaluer les retombées du traitement sur la morbidité et la mortalité, paramètre combiné qui englobe divers événements tels qu’une aggravation de l’HTAP, l’hospitalisation, la transplantation pulmonaire et le décès. Ces essais semblent indiquer que l’intensification du traitement peut ralentir la progression de la maladie. Si, par le passé, on attendait que les symptômes s’aggravent ou que la capacité fonctionnelle se détériore avant d’intensifier le traitement, l’ESC et l’ERS (European Cardiology Society et European Respiratory Society) préconisent dans leurs recommandations conjointes les plus récentes d’ajuster le traitement afin d’atteindre les objectifs visés et ainsi de faire en sorte que le patient demeure à faible risque de progression.
Généralités
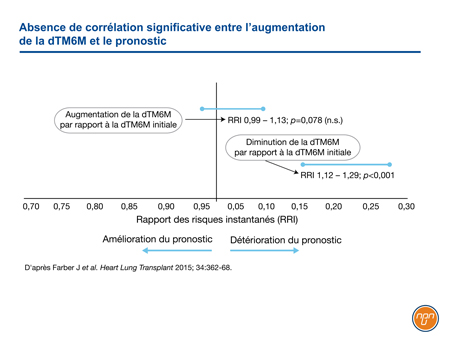
Au départ, les objectifs du traitement de l’HTAP – maladie évolutive de pronostic sombre – étaient modestes. L’époprosténol administré par voie intraveineuse (i.v.), le premier traitement spécifique de l’HTAP, a été homologué sur la base des résultats d’un essai dont le paramètre principal était une amélioration de la dTM6M à 12 semaines1. Ce test d’évaluation de l’efficacité était raisonnable à une époque où l’HTAP était souvent diagnostiquée à un stade avancé et où la médiane de survie était de seulement 3 ans. La Food and Drug Administration (FDA) américaine ayant ensuite statué que ce paramètre serait utilisé pour évaluer le bénéfice associé au traitement, il a été utilisé dans de nombreux essais pivots subséquents, y compris les essais sur le bosentan oral2, le tréprostinil sous-cutané (s.c.)3 et le sildénafil oral4. Comme plusieurs autres études, le registre REVEAL montre maintenant que même si le déclin de la dTM6M annonce un pronostic sombre, l’amélioration de la dTM6M n’est pas corrélée avec un gain de survie (Figure 1)5. Dans cette étude, aucun seuil de la dTM6M n’avait de valeur pronostique.
Figure 1.
Un groupe d’experts mandatés pour en arriver à un consensus a d’abord recommandé des paramètres axés sur la morbidité et la mortalité dans les essais cliniques amorcés en 20096. Cette recommandation avait pour but de souligner les différences éventuelles entre les traitements quant à leur capacité de modifier les résultats à plus long terme. SERAPHIN, qui s’est terminé en 2013, a été le premier essai multicentrique avec randomisation à reposer sur un paramètre principal qui regroupait des événements liés à la morbidité et à la mortalité7. Ce paramètre correspondait à l’intervalle écoulé entre, d’une part, le début du traitement et, d’autre part, le premier des événements suivants : l’aggravation de l’HTAP, le début du traitement par un prostanoïde i.v. ou s.c., une septostomie auriculaire, une transplantation pulmonaire ou le décès. Comparativement au placebo, le macitentan, antagoniste des récepteurs de l’endothéline (ARE), à la dose de 10 mg a permis une diminution de 45 % (p<0,001) du risque d’événement compris dans ce paramètre combiné. Dans plusieurs essais subséquents sur l’HTAP, le paramètre principal regroupait divers événements cliniques plutôt que de se limiter à des améliorations fonctionnelles pour l’évaluation du bénéfice associé au traitement.
À mesure qu’évolue l’HTAP, un cercle vicieux s’installe : résistance vasculaire accrue, prolifération cellulaire et remodelage vasculaire8. Selon toutes probabilités, nous avons intérêt à intervenir avant que l’atteinte tissulaire devienne irréversible pour maximiser les chances de succès. Dans le cas de l’époprosténol i.v., les gains de survie étaient plus marqués chez les patients dont la classe fonctionnelle (CF) était plus faible9. Dans le cas des autres traitements, y compris les agents oraux, il faut probablement intervenir lorsque le traitement permet encore d’atténuer le remodelage vasculaire et d’autres altérations physiopathologiques.
Outre le soulagement des symptômes et les améliorations fonctionnelles10, l’ESC et l’ERS préconisent l’atteinte de certaines cibles pronostiques dans leurs nouvelles recommandations conjointes; il devient alors nécessaire de modifier ou d’intensifier le traitement afin d’atteindre ces objectifs et ainsi de ralentir la progression de la maladie. Au nombre de ces marqueurs pronostiques figurent la normalisation du profil hémodynamique au repos, la normalisation du taux plasmatique de NT-proBNP (portion N-terminale du propeptide natriurétique de type B) et le maintien d’un VO2 max >15 mL/kg/min.
Choix du premier traitement médicamenteux
Le traitement de l’HTAP est axé sur trois voies majeures. Les premiers traitements ciblaient la voie de la prostacycline et exerçaient donc des effets vasodilatateurs, anti-inflammatoires, antiprolifératifs et antithrombotiques11. La deuxième classe d’agents homologués pour le traitement de l’HTAP ciblait la voie de l’endothéline (ET). Deux types de récepteurs, ETA et ETB, régissent les effets de l’ET-1, l’ET isoforme qui prédomine. L’ET-1 entraîne une vasoconstriction, la prolifération des fibroblastes et le remodelage vasculaire12,13. La troisième voie est quant à elle axée sur le monoxyde d’azote (NO) – puissant vasodilatateur et régulateur de la prolifération des cellules musculaires lisses – dont les signaux occasionnent d’autres altérations propres à l’HTAP, comme l’agrégation plaquettaire14. Pour cibler la voie du NO, on peut inhiber la phosphodiestérase de type 5 (PDE5) ou stimuler la guanylate cyclase soluble (GCs)4,15.
L’époprosténol, qui cible la voie de la prostacycline, est le seul traitement spécifique qui ait été associé à un gain de survie dans un essai clinique1, lequel a été mené chez des patients dont l’HTAP idiopathique était très avancée. Une diminution du taux de mortalité a été observée dans le groupe époprosténol i.v. après seulement 12 semaines de traitement. Malheureusement, le traitement par l’époprosténol est vraiment peu pratique parce qu’il requiert une perfusion continue. L’époprosténol est donc généralement réservé aux patients dont l’HTAP est avancée (CF IV) ou réfractaire.
Depuis peu, la tendance en recherche clinique est de recruter des patients dont l’HTAP est de CF II ou III. Lorsque le traitement est amorcé à un stade moins avancé, le gain de survie ne peut généralement pas être démontré durant l’essai clinique, ce qui rend les paramètres combinés morbidité-mortalité d’autant plus importants et pertinents. Dans l’essai SERAPHIN sur le macitentan et l’essai AMBITION sur l’association ambrisentan + tadalafil, par exemple, la quasi-totalité des patients présentaient une HTAP de CF III ou inférieure. Dans ces deux études, la proportion de cas de CF II s’élevait respectivement à 45 % et à 30 %, et les agents étudiés ont donné lieu à une réduction significative du risque d’événement inclus dans le paramètre combiné morbidité-mortalité7,16.
Une autre tendance se dessine depuis peu en recherche clinique : on évalue les nouveaux traitements à la fois chez des patients qui n’ont jamais été traités et des patients recevant déjà un traitement de fond stable. Dans l’essai PATENT-1, qui portait sur un agoniste de la GCs, le riociguat, environ 50 % des patients admis recevaient déjà un traitement de fond17. Dans l’essai SERAPHIN, cette proportion dépassait 60 %. Dans l’essai GRIPHON, le plus récent des essais cliniques sur l’HTAP et le plus vaste à ce jour, cette proportion s’élevait à 80 %. En fait, 33 % des sujets de l’essai GRIPHON prenaient à la fois un ARE et un inhibiteur de la PDE5. Dans cet essai, qui portait sur le selexipag, agoniste sélectif du récepteur IP qui s’administre par voie orale et qui cible la voie de la prostacycline, on a observé une diminution de 40 % du risque d’événement inclus dans le paramètre morbidité-mortalité18.
Du fait qu’ils ont objectivé une protection contre une issue défavorable sur une longue période, ces essais confirment la pertinence d’objectifs plus robustes que ceux des études antérieures. Les recommandations quant au traitement de l’HTAP ont donc dû être ajustées en conséquence. Ainsi, dans leurs recommandations conjointes de 2015, l’ESC et l’ERS préconisent une intensification du traitement afin d’obtenir non seulement une amélioration fonctionnelle, mais également une réduction du risque de détérioration clinique.
Le sildénafil, le tadalafil, l’ambrisentan, le bosentan, le macitentan, le riociguat et le selexipag ont tous reçu une recommandation de niveau I à titre de monothérapie de première intention dans l’HTAP de CF II ou III. L’époprosténol a pour sa part reçu une recommandation de niveau I à titre de monothérapie de première intention dans l’HTAP de CF III ou IV, tandis que le tréprostinil s.c. a reçu une recommandation de niveau I dans l’HTAP de CF III (tout comme le tréprostinil en inhalation et l’iloprost en inhalation; ces agents ne sont toutefois pas commercialisés au Canada à l’heure actuelle). L’association ambrisentan + tadalafil a reçu une recommandation de niveau I à titre d’association de première intention dans l’HTAP de CF II ou III. Par conséquent, nous disposons maintenant d’un grand choix d’options pour le traitement de première intention d’une HTAP de CF II ou III, qu’il s’agisse d’une monothérapie ou d’un traitement d’association. Vu l’absence de comparaisons directes de ces options de traitement, il est difficile de formuler une recommandation générale fondée sur des preuves pour le traitement de première intention. De même, on ne sait toujours pas si le traitement d’association initial est plus avantageux que le traitement d’association séquentiel. Le choix de l’une ou de l’autre option repose donc sur plusieurs facteurs, notamment la préférence du patient, l’expérience du médecin, le profil d’effets indésirables, le risque d’interaction avec les autres médicaments du patient et les affections concomitantes dont souffre le patient. La seule exception est un diagnostic d’HTAP de CF IV; en pareil cas, l’époprosténol i.v. demeure l’option à privilégier.
Intensification du traitement : marqueurs cliniques
Les données prouvant que les événements liés à la morbidité et à la mortalité des patients atteints d’HTAP peuvent être moins fréquents sous l’effet des traitements actuels ont justifié une réorientation des objectifs du traitement. De récents essais, y compris les études ayant évalué l’ajout d’une nouvelle option de traitement à un schéma de fond stable, semblent indiquer que l’intensification du traitement est une stratégie appropriée pour ralentir la progression de la maladie. Dans leurs recommandations, l’ESC et l’ERS proposent un modèle de traitement axé sur un objectif où la décision de modifier le traitement (notamment en ayant recours à une association) repose sur l’objectif de réduire au minimum le risque de détérioration10. On met l’accent sur l’importance de maintenir ou de ramener l’HTAP en CF II dans la mesure du possible. En deuxième lieu, on insiste sur l’importance d’ajuster le traitement de manière à ce que les marqueurs cliniques témoignent d’un faible risque. L’objectif est notamment d’optimiser l’index cardiaque, le taux de NT-proBNP et le VO2 max19.
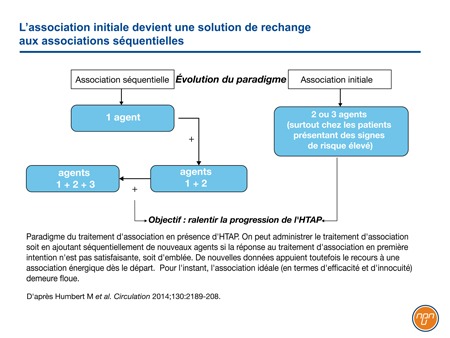
Dans leurs recommandations conjointes, l’ESC et l’ERS considèrent les associations administrées d’emblée ou séquentiellement comme appropriées pour le maintien d’un faible risque (Figure 2). Vu les effets synergiques escomptés, on pense qu’il est possible d’associer progressivement de multiples agents ayant fait la preuve de leurs effets bénéfiques à long terme afin que chacune des voies connues de la pathogenèse de l’HTAP soit ciblée simultanément.
Figure 2.
Dans les versions antérieures des recommandations conjointes de l’ECS et de l’ERS, les agents modulant la voie de la prostacycline étaient typiquement réservés aux cas avancés. Dans l’essai GRIPHON, environ 45 % des patients admis étaient aux prises avec une HTAP de CF II. Il a été démontré que l’un de ces agents était associé à un bénéfice chez 80 % des sujets de cette étude lorsqu’il était ajouté au traitement de fond à base d’un ARE, d’un inhibiteur de la PDE5 ou des deux chez 80 % des sujets de l’étude (deux agents : 33 % des patients). Cet essai semble étayer le recours précoce à un médicament agissant sur la voie de la prostacycline, même chez les patients dont la maladie est stable sous l’effet d’un traitement de fond à base d’un inhibiteur de la PDE-5 et/ou d’un ARE. Dans leurs recommandations conjointes, l’ESC et l’ERS classent le risque en trois catégories – faible, intermédiaire ou élevé – d’après divers facteurs pronostiques établis (Tableau 1).
Tableau 1.
Conclusion
Les objectifs du traitement de l’HTAP ont évolué de façon à refléter les données récentes montrant que les traitements actuels peuvent atténuer la morbidité et qu’ils sont susceptibles d’être plus efficaces en association. Dans leurs plus récentes recommandations, l’ESC et l’ERS mettent l’accent sur la surveillance des indicateurs pronostiques et sur l’intensification du traitement de façon à prévenir la détérioration clinique. Ces recommandations témoignent clairement de la volonté d’axer le traitement sur les résultats cliniques à long terme.
L’évolution du traitement de l’HTAP résulte des nombreux progrès accomplis au cours des 20 dernières années. Les efforts que l’on a déployés pour reconnaître l’HTAP plus tôt permettent maintenant de commencer à la traiter à un stade moins avancé. Des essais axés sur la survenue d’événements ont montré que les traitements commercialisés permettaient d’aller au-delà d’un simple soulagement des symptômes. L’intensification du traitement plus précoce grâce aux médicaments oraux ciblant chacun des mécanismes physiopathologiques connus de l’HTAP pourrait permettre de retarder la survenue d’événements liés à la morbidité et à la mortalité. Les médicaments administrés par voie parentérale demeurent de bons choix pour les patients aux prises avec une maladie avancée ou réfractaire à un traitement oral.
Références
1. Barst RJ, Rubin LJ, Long WA et al. A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. N Engl J Med 1996;334:296-301.
2. Rubin LJ, Badesch DB, Barst RJ et al. Bosentan therapy for pulmonary arterial hypertension. N Engl J Med 2002;346:896-903.
3. Simonneau G, Barst RJ, Galie N et al. Continuous subcutaneous infusion of treprostinil, a prostacyclin analogue, in patients with pulmonary arterial hypertension: A double-blind, randomized, placebo-controlled trial. Am J Respir Crit Care Med 2002;165:800-4.
4. Galie N, Ghofrani HA, Torbicki A et al. Sildenafil citrate therapy for pulmonary arterial hypertension. N Engl J Med 2005;353:2148-57.
5. Farber HW, Miller DP, McGoon MD et al. Predicting outcomes in pulmonary arterial hypertension based on the 6-minute walk distance. J Heart Lung Transplant 2015;34:362-8.
6. McLaughlin VV, Archer SL, Badesch DB et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension: a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association: developed in collaboration with the American College of Chest Physicians, American Thoracic Society, Inc., and the Pulmonary Hypertension Association. Circulation 2009;119:2250-94.
7. Pulido T, Adzerikho I, Channick RN et al. Macitentan and morbidity and mortality in pulmonary arterial hypertension. N Engl J Med 2013;369:809-18.
8. Sakao S, Tatsumi K, Voelkel NF. Reversible or irreversible remodeling in pulmonary arterial hypertension. American journal of respiratory cell and molecular biology 2010;43:629-34.
9. Sitbon O, Humbert M, Nunes H et al. Long-term intravenous epoprostenol infusion in primary pulmonary hypertension: prognostic factors and survival. J Am Coll Cardiol 2002;40:780-8.
10. "2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS)." Nazzareno Galie, Marc Humbert, Jean-Luc Vachiery, et al. Eur Respir J 2015; 46: 903-975. Eur Respir J 2015;46:1855-6.
11. Gomberg-Maitland M, Olschewski H. Prostacyclin therapies for the treatment of pulmonary arterial hypertension. Eur Respir J 2008;31:891-901.
12. Dupuis J, Hoeper MM. Endothelin recepotr antagonists in pulmonary arterial hypertension. Eur J Respir 2008;31:407-15.
13. Sitbon O, Morrell N. Pathways in pulmonary arterial hypertension: the future is here. Eur Respir Rev 2012;21:321-7.
14. Zuckerbraun BS, George P, Gladwin MT. Nitrite in pulmonary arterial hypertension: therapeutic avenues in the setting of dysregulated arginine/nitric oxide synthase signalling. Cardiovasc Res 2011;89:542-52.
15. Ghofrani HA, Galie N, Grimminger F et al. Riociguat for the treatment of pulmonary arterial hypertension. N Engl J Med 2013;369:330-40.
16. Galie N, Barbera JA, Frost AE et al. Initial Use of Ambrisentan plus Tadalafil in Pulmonary Arterial Hypertension. N Engl J Med 2015;373:834-44.
17. Ghofrani HA, D’Armini AM, Grimminger F et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension. N Engl J Med 2013;369:319-29.
18. Sitbon O, Channick R, Chin KM et al. Selexipag for the Treatment of Pulmonary Arterial Hypertension. N Engl J Med 2015;373:2522-33.
19. Nickel N, Golpon H, Greer M et al. The prognostic impact of follow-up assessments in patients with idiopathic pulmonary arterial hypertension. Eur Respir J 2012;39:589-96.