Comptes rendus
Évolution du traitement des maladies axiales chez les patients atteints de RP axial et de SpA axiale
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
FRONTIERES MEDICALES - Congrès européen de rhumatologie EULAR
Madrid, Espagne / 12-15 juin 2019
Madrid - Des manifestations axiales sont présentes chez un pourcentage élevé (25 à 75 %) de patients atteints de rhumatisme psoriasique (RP). Les anti-inflammatoires non stéroïdiens (AINS) demeurent la pierre angulaire du traitement au cours des premiers stades d’un RP axial et d’une spondylarthrite (SpA) axiale. En cas d’échec des AINS, il existe plusieurs traitements, et la recherche en cours pourrait nous aider à déterminer la meilleure façon de les utiliser. Les résultats de l’analyse principale de l’essai MAXIMISE chez des patients atteints de RP axial – présentés au congrès de l’EULAR – ont montré que l’inhibition de l’IL17A était associée à une meilleure réponse que le placebo. Depuis peu, le corps médical semble unanime pour dire que l’instauration précoce d’un traitement par un antirhumatismal biologique de fond (bDMARD) – avant la survenue de lésions irréversibles – pourrait optimiser les résultats.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
« Les enthésites et l’inflammation sont au cœur de la physiopathologie de la spondylarthrite ankylosante (SpAA) », explique le Pr Georg Schett, département de médecine interne 3, Université Friedrich-Alexander, Erlangue, Allemagne. Même si l’inflammation dans certaines zones résulte d’un stress mécanique élevé, la voie de l’IL17A contribue étroitement au processus pathologique et à l’inflammation responsables des lésions et de la progression de la maladie dans les dorsalgies inflammatoires. « À mon avis, si l’on arrive à enrayer l’inflammation, il devient possible de faire obstacle à la formation d’enthésophytes, notamment en bloquant l’IL17A au début du processus », affirme la Dre Ellen Gravallese, division de rhumatologie, University of Massachusetts Medical School, États-Unis. L’IL17A est donc considérée comme l’une des principales cibles du traitement de la SpA axiale et des manifestations axiales du RP.
Une analyse groupée post hoc est venue étayer l’efficacité de la stratégie anti-IL17A chez 693 patients aux prises dès le départ avec des enthésites associées à une SpAA (score MASES [Maastricht AS Enthesitis Score] > 0) qui avaient participé aux quatre essais MEASURE présentés par le Pr Schett. Cette analyse a montré que le sécukinumab à 150 et à 300 mg était associé à des réductions plus marquées des enthésites selon le score MASES global et l’évaluation des enthèses axiales à 16 semaines comparativement au placebo; ces réductions se maintenaient à 52 semaines.
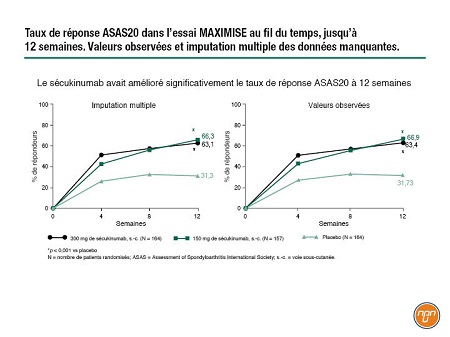
L’essai MAXIMISE a été conçu pour tester l’utilité de l’inhibition de l’IL17A dans le RP axial. Toujours en cours, cette étude de phase III menée à double insu avec randomisation regroupe 503 patients atteints de RP qui sont aux prises avec une maladie et des douleurs spinales actives. Ces patients – qui n’avaient pas eu de réponse adéquate à au moins 2 AINS en 4 semaines – ont été randomisés selon un rapport 1:1:1 de façon à recevoir 300 mg de sécukinumab, 150 mg de sécukinumab ou un placebo (Figure 1). Après 12 semaines, les patients recevant un traitement actif ont continué de prendre la même dose alors que les patients sous placebo ont été randomisés de manière à recevoir 300 mg ou 150 mg de sécukinumab pendant 40 semaines. Sur le plan de l’efficacité, le paramètre principal était la réponse ASAS (Assessment of Spondyloarthritis International Society) 20 à 12 semaines. Les résultats à 12 semaines, maintenant disponibles, ont été présentés au congrès par le Dr Xenofon Baraliakos, Centre de rhumatologie, Université de la Ruhr, Bochum, Allemagne. Les groupes de traitement étaient bien équilibrés en termes de caractéristiques démographiques et d’antécédents de maladie axiale. Environ les deux tiers des patients sous traitement actif avaient répondu au traitement à 12 semaines, comparativement à environ le tiers des patients sous placebo. « Pour ce qui est de la dynamique de la réponse au traitement, nous observons une réponse rapide qui s’accentue légèrement avec le temps », explique le Dr Baraliakos (Figure 2). Les chercheurs ont observé une réponse sans égard à l’usage concomitant de méthotrexate. Sur le plan de l’innocuité, les résultats étaient conformes aux données antérieures.
Figure 1. Aperçu du plan de l’essai MAXIMISE

Figure 2. Taux de réponse ASAS20 dans l’essai MAXIMISE au fil du temps, jusqu’à 12 semaines. Valeurs observées et imputation multiple des données manquantes.
Quels agents biologiques devrait-on utiliser dans
le traitement des dorsalgies inflammatoires?
Selon le guide de pratique en vigueur, les AINS sont recommandés en 1re intention. Après l’échec d’au moins 2 AINS, il est recommandé de passer à un agent biologique. Il est fréquent que l’on opte alors pour un anti-TNF, en partie parce que cette classe est bien établie, mais la présence d’affections concomitantes et d’autres facteurs pourraient aussi être pris en compte. En particulier, l’efficacité d’un anti-IL17A dans la prise en charge des manifestations cutanées chez les patients atteints d’un RP axial donne tout lieu de croire que ces agents seraient préférables chez les patients aux prises avec une maladie axiale et une atteinte cutanée. Les résultats d’un essai comparatif direct mené en mode ouvert (SPIRIT) sur un anti-IL17A (ixékizumab) et un anti-TNF (adalimumab) chez des patients atteints de RP et de psoriasis actifs jamais traités par un agent biologique ont fait l’objet d’un résumé de dernière heure au congrès. L’anti-IL17A s’est révélé supérieur à l’anti-TNF selon le paramètre principal mixte (réponse ACR50 et PASI100 à 24 semaines). Nous aurons accès aux résultats de l’essai comparatif direct EXCEED qui compare le sécukinumab et l’adalimumab dans le traitement du RP actif (l’essai devrait se terminer plus tard cette année).
Le choix de l’agent biologique à utiliser après l’échec du premier agent biologique ou d’un agent biologique subséquent est une question plus complexe. Ce sont principalement des patients jamais exposés à un agent biologique qui ont été recrutés dans la plupart des essais pivots sur les agents biologiques maintenant commercialisés. Des patients déjà exposés à un anti-TNF ont aussi été recrutés dans l’essai MEASURE-2, mais leur réponse au sécukinumab a été moins marquée que celle de leurs pairs jamais exposés à un agent biologique. Cela dit, en général, les preuves à l’appui de la décision à prendre après l’échec d’un agent biologique de 1re intention proviennent en grande partie de l’expérience clinique. Bien que, par le passé, l’expérience clinique ait souvent été considérée comme peu solide pour étayer la prise de décisions, on reconnaît de plus en plus qu’elle peut jeter un éclairage précieux lorsque des essais cliniques rigoureux ne peuvent pas nous donner de réponse.
Données de la pratique
L’une des bases de données les plus vastes sur l’utilisation des agents biologiques chez les patients atteints de SpA est un réseau de registres (EuroSPA) de 15 pays d’Europe. Une étude reposant sur 12 des 15 registres de ce réseau a porté sur l’utilisation d’un anti-TNF en 1re, 2e et 3e intention chez des patients atteints de SpA axiale. Chez 7953 et 2782 patients amorçant leur 2e et 3e anti-TNF, respectivement, une maladie inactive selon le score ASDAS (Ankylosing Spondylitis Disease Activity Score) a été signalée chez 18 % et 13 % des patients à 6 mois. « La diminution du taux de rémission est inversement proportionnelle à l’augmentation du nombre d’anti-TNF antérieurs », explique le Pr Mikkel Østergaard, Université de Copenhague, Danemark. Compte tenu du taux de réponse faible et décroissant en présence d’un nombre croissant d’anti-TNF, il serait justifié de poursuivre la recherche pour déterminer si le passage à un autre mécanisme, l’inhibition de l’IL17A par exemple, serait plus approprié après l’échec d’un premier anti-TNF.
Traitement précoce de la SpA non radiographique
Dans le spectre de la SpA, on privilégie de plus en plus un traitement énergique par un bDMARD dès le départ afin de limiter l’apparition de lésions irréversibles causées par les processus inflammatoires. L’un des points litigieux est la prise en charge des patients ayant des manifestations axiales qui ne répondent pas aux critères traditionnels de la SpAA, mais qui répondraient à ceux d’une SpA axiale non radiographique (nr) selon la terminologie actuelle. Il existe un système de classification pour la SpAA, mais il n’y a aucun test diagnostique. « Il faut donc se fier à sa propre expertise lorsqu’on traite ces patients », estime le Dr Robert Landewé, Centre médical de l’Université d’Amsterdam, Pays-Bas.
Dans de nombreux cas où la SpAA serait exclue faute de lésions visibles à la radiographie, l’examen d’imagerie par résonance magnétique (IRM) montre des signes d’inflammation. « En pareils cas, nous devons diagnostiquer la maladie beaucoup plus tôt, avant l’apparition d’enthésophytes », poursuit le Dr Landewé. Il y a somme toute peu de patients atteints de SpAA traditionnelle, mais si l’on se met en tête de trouver des patients dont la maladie est moins avancée, on en repère beaucoup plus », ajoute-t-il. L’étude GESPIC (German Spondyloarthritis Inception Cohort) a révélé qu’en 2 ans la maladie avait évolué vers une SpAA chez seulement 12 % des patients ayant reçu un diagnostic confirmé de SpA axiale nr; le défi, c’est donc de cerner les patients dont la SpA axiale nr évoluera vers une SpAA afin d’épargner un traitement inutile à ceux qui ne sont pas à risque. La présence d’inflammation à l’IRM semble un bon prédicteur du risque. Lors d’une étude menée chez des patients souffrant de dorsalgies inflammatoires précoces (ancienneté de moins de 2 ans), mais n’ayant toujours pas reçu de diagnostic, la présence d’une sacro-iliite sévère et de l’antigène HLA-B27 multipliait par 8 le risque d’apparition d’une SpAA, alors que si la sacro-iliite était légère ou absente, le risque était multiplié par 0,4, que l’antigène HLA-B27 ait été présent ou non. « Nous savons que l’inflammation est un facteur déclenchant clé de la progression et de l’apparition de lésions structurelles et que si l’on arrive à enrayer l’inflammation, il y aura moins de lésions structurelles », indique le Pr Schett.
Guide de pratique
Le traitement de la SpA axiale s’appuie sur le concept voulant que l’on traite les patients jusqu’à ce qu’ils parviennent à une rémission clinique ou que leur maladie devienne inactive, « la rémission clinique/la maladie inactive se définissant par l’absence de preuves cliniques et biologiques d’une activité importante de la maladie. Il s’agit là d’un point important » selon le Pr Denis Poddubnyy, Hôpital universitaire de la Charité, Berlin, Allemagne, « parce que maintenant, nous tenons compte non seulement du profil clinique, mais aussi du taux de CRP, cette protéine étant un prédicteur de l’évolution vers des lésions structurelles ». Chez certains patients, il est possible d’enrayer les processus inflammatoires temporairement à l’aide des AINS, mais les AINS ne suffisent pas chez d’autres patients, et il faut alors avoir recours à un anti-TNF ou à un anti-IL17A. Dans le cas des anti-TNF, il a été démontré qu’une intervention précoce était importante. Par exemple, une analyse post hoc des résultats stratifiés selon l’ancienneté des symptômes de SpA axiale nr (< 5 vs ≥ 5 ans au départ) a montré que l’amélioration de multiples signes et symptômes de la maladie était d’autant plus marquée que ces signes et symptômes étaient récents. Une fois amorcée la progression, cependant, le traitement anti-TNF ne ralentit pas la progression de la maladie de manière significative.
Conclusion
Il y a de plus en plus de traitements offerts pour les patients atteints de RP axial ou de SpA axiale présente isolément ou avec un RP axial. Nous commençons à avoir des données pour orienter les décisions thérapeutiques, lesquelles devraient idéalement se prendre en contexte multidisciplinaire, surtout si des manifestations extra-articulaires sont présentes, et toujours en consultation avec le patient. La tendance actuelle est de passer plus rapidement à un agent biologique, tel un anti-IL17A qui cible spécifiquement le type d’inflammation observée en présence d’une atteinte axiale, afin de limiter la progression des lésions structurelles.
Questions et réponses
Nous avons posé quelques questions au Dr Xenofon Baraliakos, Centre de rhumatologie, Université de la Ruhr à Bochum, en Allemagne, et au Pr Dennis McGonagle, Faculté de médecine, University of Leeds, Royaume-Uni. Voici leurs réponses.
Q : Y a-t-il une population de patients qui échappent à la fois aux guides de pratique et aux essais cliniques?
Dr Xenofon Baraliakos : Oui, il y a un sous-groupe de patients qui souffrent principalement de rhumatisme psoriasique (RP) mais qui présentent aussi des dorsalgies inflammatoires d’intensité croissante. Comme nous savons que le RP découle principalement d’enthésites, peut-être devrions-nous utiliser un médicament qui cible spécifiquement les enthésites, par exemple le sécukinumab ou les inhibiteurs de l’IL17A en général. Nous n’avons pas encore toutes les données en main, mais c’est la première fois que nous présentons des données chez ces patients en particulier dans un congrès, et nous avons observé une excellente réponse en 12 semaines seulement.
Q : Vous faites référence à l’essai MAXIMISE? Comme il a été présenté uniquement à ce congrès, faut-il conclure que ses résultats ne seront pas inclus dans la mise à jour du guide de pratique de l’EULAR?
Dr Xenofon Baraliakos : Je doute qu’on en tienne compte, car d’un point de vue purement logistique, le guide de pratique est déjà en cours de révision. Cela dit, l’essai sera assurément pris en compte dans la pratique clinique, car les symptômes axiaux revêtent tellement une grande importance.
Q : Ainsi, en présence de symptômes axiaux, les anti-TNF ne sont pas considérés?
Dr Xenofon Baraliakos : Il ne fait aucun doute que nous les considérons, mais nous n’avons actuellement aucune donnée montrant clairement qu’ils sont efficaces en pareil cas. Je ne pense pas qu’ils seraient inefficaces, mais seraient-ils d’efficacité comparable? Si les enthésites sont au cœur du problème, les anti-IL17A semblent supérieurs. Il faut se demander quel traitement en particulier conviendrait à ce type de patient et, selon notre compréhension actuelle des choses, les anti-IL17A semblent plus spécifiques.
Q : Y a-t-il une population de patients qui échappent à la fois aux guides de pratique et aux essais cliniques?
Pr Dennis McGonagle : Il y a entre autres le groupe des patients aux prises avec une polyenthésite. Ces patients sont difficiles à reconnaître cliniquement, et il est difficile de confirmer le diagnostic hors de tout doute au moyen d’un examen d’imagerie. Ce groupe n’est pas très bien reconnu dans les guides de pratique actuels parce que l’on craint que de nombreux patients aux prises avec des douleurs diffuses chroniques et des douleurs mécaniques reçoivent à tort un diagnostic de polyenthésite et, par conséquent, un traitement inapproprié, ce qui pourrait être dangereux pour eux et faire monter en flèche les coûts assumés par les tiers-payeurs.
Q: Y a-t-il des études dont les auteurs des guides de pratique pourraient tenir compte pour combler ces lacunes?
Pr Dennis McGonagle : Il est largement reconnu qu’il faut perfectionner les examens d’imagerie afin de réussir à cerner l’hétérogénéité du RP. Pensez à une personne atteinte de polyarthrite rhumatoïde : si vous avez recours à l’échographie pour voir une articulation, généralement périphérique, vous voyez en gris d’intensité diverse l’épaississement de la synoviale, et vous savez que c’est un tissu pathologique. À défaut d’intervention ou de traitement, il en résulte une érosion et une destruction. Le RP s’accompagne également de synovite; on peut le visualiser à l’échographie. Cependant, il peut aussi y avoir une lourde atteinte axiale et des enthésopathies. Les enthèses étant plutôt avasculaires et fortement innervées, les douleurs sont intenses à cause d’une véritable inflammation, mais c’est impossible à voir sur des clichés d’imagerie. Il faut avoir recours à l’IRM en raison de la profondeur et de l’inaccessibilité des structures touchées.
D’après des séances scientifiques officiellement reconnues par le Congrès européen annuel de rhumatologie (EULAR) qui a eu lieu à Madrid, en Espagne, du 12 au 15 juin 2019.