Comptes rendus
Prise en charge des neurofibromes plexiformes associés à la NF1 : nouvelle option pour les cas inopérables
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PRESSE PRIORITAIRE - NF Conference 2023 : Children’s Tumor Foundation (CTF)
En présentiel/virtuel, Scottsdale, Arizona / 24–27 juin 2023
Scottsdale – Assemblée annuelle phare de la Children’s Tumor Foundation (É.-U.), la NF Conference a réuni en juin à Scottsdale, en Arizona, plus de 700 participants de partout dans le monde. Il a été question de récentes recherches, opinions et directives cliniques sur la neurofibromatose (NF) et la schwannomatose, maladies héréditaires rares pouvant donner lieu à des cancers. La NF de type 1 (NF1) – la forme la plus courante de NF – est due à une mutation du gène codant la neurofibromine, protéine suppresseur de tumeur, d’où une dysrégulation de la voie de signalisation RAS-MAPK. Dotée d’un tableau clinique très variable, la NF1 se manifeste surtout par des changements dans la pigmentation de la peau (taches café au lait et/ou lentigines inhabituelles aux aisselles ou aux aines, typiquement), des retards d’apprentissage et de développement, et l’apparition de multiples neurofibromes sur la peau (neurofibromes cutanés) et/ou la gaine des nerfs périphériques (neurofibromes plexiformes, NP). Ce rapport portera sur l’importance des NP chez les patients atteints d’une NF1 et sur les progrès dans la prise en charge des NP associés à la NF1 (NP-NF1).
Re´dactrice me´dicale en chef : Dre Le´na Coi¨c, Montre´al, Que´bec
« Les NP – qui peuvent survenir chez jusqu’à 50 % des patients atteints d’une NF1 – peuvent être douloureux et mortels », affirme Theresa Dettling, Alexion Pharmaceuticals. Jusqu’à tout récemment, la chirurgie était la principale option de prise en charge d’un NP symptomatique; cela dit, explique MmeDettling, « l’exérèse chirurgicale est souvent difficile, voire impossible, à cause de la taille du NP et de sa proximité avec des organes vitaux. » Après avoir examiné le dossier d’enfants aux prises avec des NP-NF1 inopérables à une époque où les pharmacothérapies ciblées n’étaient pas courantes, Mme Dettling et al. ont montré que la maladie progressait chez environ les trois quarts des patients, entraînant généralement une exacerbation des douleurs et un défigurement. Les NP inopérables sont aussi associés à une utilisation importante des ressources du système de santé; les patients devaient se présenter en moyenne à 6,1 visites externes par année et près de la moitié avaient dû être hospitalisés durant la période de 8,3 ans. « La surveillance et le traitement des patients atteints d’un NP-NF1 représentent un lourd fardeau, notamment pour le système de santé», conclut-elle1.
Le sélumétinib est un inhibiteur oral de MEK, kinase clé dans la cascade de signalisation RAS-MAPK. En 2022, il est devenu le premier médicament homologué au Canada pour la prise en charge d’un NP-NF1 symptomatique et inopérable chez les 2 à 18 ans. Les principales données à l’appui de l’efficacité du sélumétinib proviennent de l’essai clinique de phase II SPRINT : environ les deux tiers des patients sont parvenus à une réponse objective (réduction ≥ 20 % du volume du NP et/ou disparition du NP cible) au sélumétinib, et > 80 % de l’ensemble des patients ont obtenu une réponse, tous niveaux de réponse confondus, d’au moins 1 an2.
Le sélumétinib pour la prise en charge d’un NP-NF1 inopérable dans la pratique
Le sélumétinib étant commercialisé dans plusieurs pays pour la prise en charge des NP-NF1 inopérables, son impact sur la pratique se concrétise. Le Dr Thorsten Rosenbaum, Sana Kliniken, Duisbourg, Allemagne, a présenté l’expérience de son centre avec le tramétinib (indication non approuvée, jusqu’à 2021) et le sélumétinib (homologué par l’EMA en 2021) au cours des 5 dernières années chez 24 patients avec NP-NF1 : 10 patients sous tramétinib sont passés au sélumétinib lorsqu’il a été commercialisé; les 14 autres ont reçu exclusivement du sélumétinib. Selon les mesures volumétriques par IRM (n = 21), la tumeur avait diminué de volume chez 71,4 % des patients (n = 15) sous inhibiteur de MEK, la réduction moyenne atteignant 23 % ± 16,9 % (extrêmes : 2,7 % et 72,8 %). Les effets indésirables (EI) les plus fréquents étaient les éruptions cutanées, la paronychie et les nausées. « Le traitement par le sélumétinib réduit substantiellement le volume du NP-NF1 chez la majorité des patients, concluent les auteurs. En général, les EI liés au traitement sont légers et se traitent, et semblent moins fréquents chez les jeunes enfants3. »
Theresa Dettling et al. ont présenté les résultats d’un sondage auprès de 16 aidants d’enfants avec NP-NF1. « Le but était de mieux comprendre le vécu des enfants du point de vue de l’aidant après l’instauration du traitement par le sélumétinib », expliquent les auteurs. Les principaux objectifs du traitement étaient la réduction de la tumeur (43,8 % des répondants) ou sa stabilisation (37,5 %), et le soulagement de la douleur liée à la tumeur (31,3 %). Selon la plupart des aidants, la tumeur s’était stabilisée ou avait diminué de volume depuis l’instauration du traitement par le sélumétinib. Dans la majorité des cas, l’aidant a fait état d’une amélioration de la douleur et de la fatigue (Figure 1A) et du fonctionnement socio-émotionnel (Figure 1B)4.
Figure 1. Impact du sélumétinib sur (A) la douleur et la fatigue et (B) la vie sociale, la vie mentale, les émotions et l’apprentissage, selon les aidants
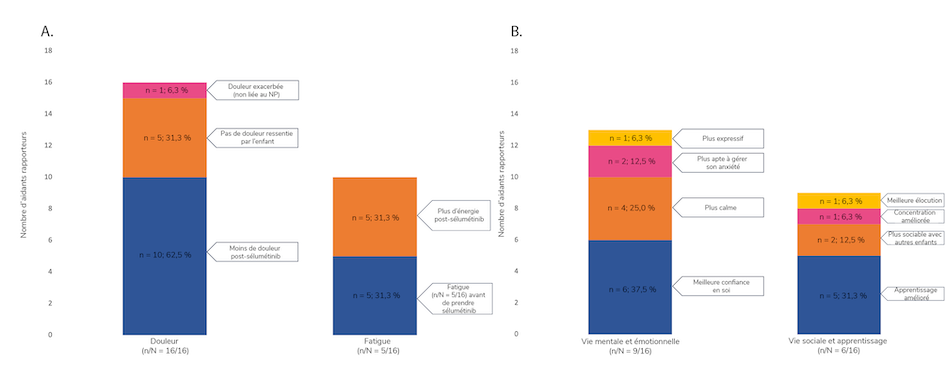
n, nombre d’aidants rapportant une amélioration dans la catégorie précisée; N, nombre total d’aidants inclus dans l’étude; NP, neurofibrome plexiforme. D’après Dettling T et al. Affiche 32, NF Conference 20234.
Possibilités d’avenir pour les inhibiteurs de MEK
Le sélumétinib doit se prendre à jeun (au moins 2 heures avant ou 1 heure après un repas), selon les études de pharmacocinétique (PK) ayant montré l’effet de la nourriture sur son absorption2. La posologie de 2 doses/jour est très contraignante, notamment pour l’heure des repas et de la médication. « C’est pourquoi nous voulons mieux comprendre l’effet de la nourriture sur la PK du sélumétinib », explique Million Arefayene, Alexion Pharmaceuticals. En introduction de son analyse des paramètres PK du sélumétinib et de son métabolite actif chez les participants de 15 essais cliniques, il a indiqué que son analyse regroupait 511 sujets, dont 91 enfants et 86 adultes atteints de NF1, et 334 adultes volontaires en santé. L’exposition au sélumétinib mesurée par l’aire sous la courbe a été réduite légèrement lorsque la dose était ingérée avec un repas pauvre en gras (réduction de 22,5 %) ou riche en gras (réduction de 20,8 %), comparativement à une prise à jeun. Ces réductions n’ont pas été considérées comme cliniquement significatives parce que, à l’intérieur de l’éventail posologique testé, de petites variations de l’exposition au sélumétinib ont un effet minime sur la réponse au traitement. Les résultats étaient similaires pour le métabolite actif; il se pourrait donc que la recherche permette de modifier la posologie indiquée dans la monographie du sélumétinib. « Nous sommes heureux de présenter ces données aux scientifiques et encouragés à l’idée de faire progresser les soins offerts à la communauté NF1 et possiblement d’alléger le fardeau des enfants et de leur famille, poursuit M. Arefayene. Nous en sommes à évaluer les données et les prochaines étapes. Nous dévoilerons plus d’information en temps et lieu, mais j’estime important de souligner pour l’instant que le sélumétinib est actuellement homologué pour une prise à jeun5[sp1] . »
Il a aussi été question de deux autres inhibiteurs de MEK, le tramétinib et le binimétinib, dans la prise en charge du NP-NF1. Aucun n’est homologué pour le NP-NF1 au Canada.
Le tramétinib est un inhibiteur de MEK indiqué pour le traitement de certains mélanomes et cancers du poumon qui s’utilise dans le NP-NF1 sans être homologué pour cette indication. Les données dans la NF1 et d’autres tumeurs neurologiques étant limitées, le Dr Sébastien Perreault, CHU Sainte-Justine, Montréal, et al., ont mené l’essai de phase II ouvert non randomisé TRAM-01 pour explorer l’innocuité et l’efficacité du tramétinib dans plusieurs types de tumeurs neurologiques, dont le NP-NF1 (n = 46). De grade 1 ou 2, la plupart des effets indésirables (EI) ont pu être traités sans modification de la dose, mais la dose a été réduite chez 9 patients à cause d’EI (surtout cutanés), et 4 patients ont arrêté le traitement à cause d’EI. Un peu moins de la moitié des patients ont obtenu une réponse partielle (réduction ≥ 20 % de la tumeur selon l’analyse volumétrique) durant le traitement, après un intervalle médian de 11 mois. Après 18 mois de traitement, certains patients perdaient leur réponse, la maladie ayant même progressé chez 2 patients. Un an après l’arrêt du traitement, la réponse partielle se maintenait chez environ le tiers des patients. « En conclusion, le tramétinib s’est révélé efficace dans le NP, dit le Dr Perreault. Il a été généralement bien toléré, mais comme d’autres l’ont montré, un traitement prolongé semble nécessaire chez la plupart des patients6.»
Le binimétinib est un autre inhibiteur de MEK indiqué pour la prise en charge du mélanome, mais pas du NP-NF1. La Dre Alyssa Reddy, UCSF Benioff Children's Hospitals, San Francisco, et al. ont présenté le suivi d’un essai de phase II sur le binimétinib dans lequel la reprise du traitement était possible en cas de progression du NP après les 24 premiers mois de l’étude. Même si la plupart des patients de l’essai initial avaient obtenu une réponse partielle, la maladie a progressé après l’arrêt du traitement chez 78 % des enfants et 40 % des adultes. La plupart des patients ont de nouveau répondu au binimétinib à la reprise du traitement. « Ces données semblent indiquer que la plupart des enfants ont besoin d’un traitement prolongé pour maintenir une réponse partielle, concluent les auteurs. Nous devons faire d’autres études pour déterminer la durée optimale du traitement, et une surveillance continue de la toxicité est justifiée7. »
Conclusions
Les neurofibromes plexiformes peuvent avoir un grand impact sur la vie des patients atteints de NF1 et leurs interactions avec le système de santé. Le sélumétinib est une nouvelle option de traitement pour les NP-NF1 inopérables qui pourrait être avantageuse pour l’issue clinique et le vécu des patients et de leurs aidants. Les recherches futures seront axées sur l’impact de l’ingestion de nourriture sur la pharmacocinétique du sélumétinib et sur le profil d’efficacité et d’innocuité cliniques d’autres inhibiteurs de MEK.
Références
1. Dettling T et al. Communication orale, Conférence 2023 sur la NF, 24-27 juin 2023.
2. Monographie de KOSELUGO (sélumétinib). AstraZeneca Canada Inc., Mississauga, Ontario, Canada. Date de l’autorisation initiale: 23 août 2022.
3. Rosenbaum T et al. Affiche 122, Conférence 2023 sur la NF, 24-27 juin 2023.
4. Dettling T et al. Affiche 32, Conférence 2023 sur la NF, 24-27 juin 2023.
5. Arefayene M et al. Communication orale, Conférence 2023 sur la NF, 24-27 juin 2023.
6. Perreault[sp2] S et al. Communication orale, Conférence 2023 sur la NF, 24-27 juin 2023.
7. Reddy A et al. Affiche 110, Conférence 2023 sur la NF, 24-27 juin 2023.