Comptes rendus
Optimiser l’adhésion au traitement immunosuppresseur pour améliorer la capacité fonctionnelle du greffon à long terme
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
FRONTIÈRES MÉDICALES - 24e Congrès international de la Transplantation Society
Berlin, Allemagne / 15-19 juillet 2012
Berlin - L’issue à long terme des transplantations s’est améliorée depuis le début des années 1980, mais des difficultés demeurent, tels l’âge toujours plus avancé des receveurs et des donneurs et l’utilisation croissante d’organes provenant de donneurs à critères étendus, autant de facteurs qui influent sur la capacité fonctionnelle du greffon. Les inhibiteurs de la calcineurine (ICN) constituent la pierre angulaire du traitement immunosuppresseur. La minimisation des doses peut entraîner une inflammation subclinique, laquelle peut paver la voie à la formation d’anticorps spécifiques du donneur de novo et à un éventuel rejet médié par les anticorps, alors qu’une immunosuppression trop profonde exposera le patient à un risque d’infection, de toxicité et de cancer. L’optimisation du traitement immunosuppresseur est donc la stratégie la plus efficace pour prévenir ces événements. Les mesures qui simplifient le schéma immunosuppresseur et qui améliorent l’adhésion au traitement – telle l’utilisation d’un ICN 1 fois/jour – pourraient améliorer les résultats à long terme.
Rédactrice médicale adjointe : Dre Julie Frère, Montréal, Québec
La médecine de la transplantation se heurte actuellement à certaines difficultés, notamment l’âge toujours plus avancé des donneurs et des receveurs ainsi que l’utilisation croissante d’organes provenant de donneurs à critères étendus (DCE). Chacun de ces facteurs est en soi associé à l’obtention de moins bons résultats après une allogreffe rénale. «De plus en plus de patients de 60 ans ou plus sont maintenant transplantés», confirme le Pr Gerhard Opelz, professeur titulaire et directeur, Département de transplantation et d’immunité, Universität Heidelberg, Allemagne, «et, de toute évidence, les patients plus âgés se tirent moins bien d’affaire que les plus jeunes».
Chez les patients âgés, le risque cardiovasculaire (CV) est aussi plus élevé, ce qui augmente significativement le risque de décès d’origine CV au moment de la transplantation. La probabilité de décès toutes causes confondues et d’événements coronariens aigus majeurs est aussi significativement plus élevée dans l’éventualité d’une perte de greffon qu’en présence d’un greffon fonctionnel. En Europe, plus du tiers de tous les donneurs sont maintenant considérés comme des DCE, et le taux de survie des greffons provenant de ces donneurs est significativement plus faible que le taux de survie des greffons provenant d’autres catégories de donneurs, souligne le Pr Opelz. L’âge du donneur est un facteur qui influe grandement sur la capacité fonctionnelle du greffon.
La population de la vaste étude OSAKA avec randomisation est hautement représentative des transplantés rénaux en Europe à l’heure actuelle. Les résultats ont en effet montré que l’âge du donneur était le plus important facteur prédictif d’un échec à 24 semaines, l’échec ayant été défini pour les besoins de l’étude par un paramètre regroupant la perte de greffon, le rejet aigu confirmé par biopsie (RACB) et le dysfonctionnement du greffon (débit de filtration glomérulaire estimé [DFGe] <40 mL/min/1,73 m2). En effet, le taux d’échec était <30 % si l’âge du donneur était <30 ans alors qu’il était >70 % si l’âge du donneur était >70 ans.
Résultats à court et à long terme
Il semble que l’impact du rejet aigu sur la survie à long terme du greffon dépende du moment où le rejet survient. À en juger par des résultats d’études, l’épisode a peu d’impact sur l’issue à long terme s’il survient moins de 90 jours après la transplantation. Par contre, même si le greffon redevient fonctionnel à la suite d’un épisode survenu plus de 90 jours après la transplantation, «le rejet aura un impact sur l’issue à long terme», note le Pr Opelz.
De plus en plus, on opte pour des schémas sans inhibiteur de la calcineurine (ICN) ou à base d’ICN à faible dose afin d’atténuer le risque de néphrotoxicité imputable aux ICN. Cependant, comme l’explique le Pr Bengt Fellström, professeur titulaire de néphrologie, Hôpital universitaire d’Uppsala, Suède, le médecin doit soupeser le risque de néphrotoxicité de l’ICN en regard du risque d’immunosuppression insuffisante et du risque subséquent de formation d’anticorps spécifiques du donneur de novo (ASDdn) et de rejet médié par les anticorps. Lorsqu’il a évalué des essais où les patients étaient passés pour la plupart d’un schéma à base d’un ICN à un schéma à base d’un inhibiteur de mTOR (mammalian target of rapamycin), le DFGe était en général significativement meilleur sous inhibiteur de mTOR que sous ICN. Avec le temps, cependant, l’avantage finissait souvent par disparaître, «ce qui donne tout lieu de croire que l’augmentation à court terme du DFGe ne se traduit pas forcément par une prolongation de la survie à long terme du greffon», poursuit le Pr Fellström.
Le Pr Daniel Serón, professeur titulaire de médecine, Universitat Autònoma de Barcelona, Espagne, précise pour sa part que la prévalence de la néphrotoxicité des ICN varie substantiellement d’un centre à l’autre, chacun ayant sa propre définition de la néphrotoxicité d’un ICN. Chez les patients recevant un organe autre que le rein, la glomérulonéphrite, la néphropathie diabétique et la microangiopathie thrombotique sont très fréquentes.
Causes de la perte d’allogreffon rénal
Dans une étude citée par le Pr Serón (El-Zoghby et al. Am J Transplant 2009;9[3]:527-35), les chercheurs se sont penchés sur les causes précises de la perte d’allogreffon rénal chez 1317 transplantés rénaux. Au cours des 50,3 mois de suivi, ils ont enregistré 330 pertes de greffon. Parmi les pertes de greffon imputables à une défaillance fonctionnelle – à l’exclusion des décès – (n=153), plus des deux tiers étaient imputables à une pathologie glomérulaire ou à une fibrose/atrophie (Tableau 1). Un seul cas de fibrose/atrophie a été imputé à la toxicité de l’ICN. La présence d’une inflammation subclinique précoce – très fréquente dans le rein transplanté – est un facteur de risque de progression vers la chronicité des lésions et d’apparition d’ASDdn, fait aussi remarquer le Pr Serón. «Plus l’inflammation est marquée dans la première biopsie, plus le risque de progression vers la fibrose interstitielle est élevé et moins les résultats sont bons», ajoute-t-il.
Tableau 1. Causes des pertes de greffon fonctionnel au cours de différentes périodes après la transplantation1
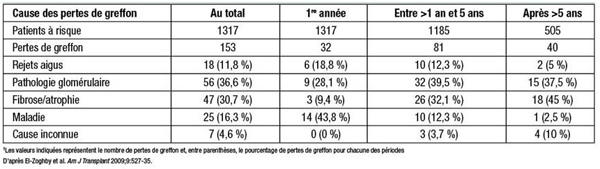
«L’inflammation est de mauvais augure pour le rein; elle est associée à la progression de la fibrose de même qu’à une probabilité plus forte de rejet médié par les anticorps, et tout cela dépend fortement du type d’immunosuppresseur que le patient reçoit», fait remarquer le Pr Serón. Les résultats de Moreso et al. (Transplantation 2004;78:1064-8), par exemple, montrent que le risque de rejet aigu probable et le risque de rejet de grade I-II sont plus faibles sous tacrolimus que sous cyclosporine chez des patients recevant des schémas immunosuppresseurs par ailleurs identiques. À en juger par les résultats d’une étude citée par le Pr Serón, la probabilité de formation d’ASDdn et de rejet médié par les anticorps semble plus forte lorsque les patients passent d’un schéma à base d’un ICN à un schéma à base d’un inhibiteur de mTOR.
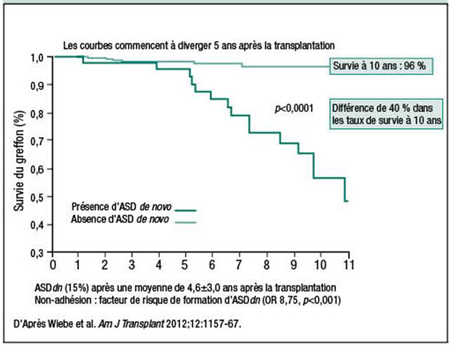
L’impact des ASDdn n’est pas banal, rapporte-t-on dans une étude canadienne récente (Wiebe et al. Am J Transplant 2012;12:1157-67). Les chercheurs ont observé une différence de 40 % dans les taux de survie du greffon rénal à 10 ans entre les patients qui avaient développé des ASDdn en moyenne 4,6 ans après la transplantation et ceux qui n’en avaient pas développé (Figure 1).
Figure 1. ASDdn et diminution de la survie du greffon après la transplantation rénale
De plus, au cours des 10 dernières années, des chercheurs européens ont recueilli des données pour un registre sur la diminution de la dose de l’ICN ou l’éviction de l’ICN au cours de la deuxième année suivant la transplantation du rein. Les résultats indiquent clairement que la survie du greffon était meilleure lorsque le traitement immunosuppresseur à base d’un ICN s’était poursuivi que lorsque la dose de l’ICN avait été réduite ou que le traitement par l’ICN avait été arrêté (Figure 2).
Figure 2. Diminution de la dose de l’ICN ou arrêt du traitement par l’ICN (2e année)
Transplantations de reins provenant de donneurs décédés (2000-2010
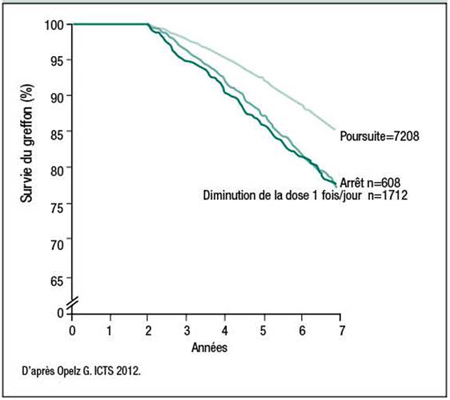
Les données du registre européen montrent que les résultats étaient moins bons chez les quelques centaines de patients qui étaient passés d’un schéma immunosuppresseur à base d’un ICN à un schéma à base d’un inhibiteur de mTOR (Opelz G, Döhler B. Transplantation 2008;86:371-6). «Le changement était peut-être bien intentionné, mais la survie du greffon après le changement a été moins bonne; on ne peut donc pas aveuglément remplacer l’ICN par un inhibiteur de mTOR en raison du risque de réaction immunitaire», fait valoir le Pr Opelz.
Fondamentalement d’accord avec les autres conférenciers, le Pr Barnhard Banas, professeur titulaire de médecine interne et de néphrologie, Universität Regensburg, Allemagne, a toutefois souligné que la néphrotoxicité des ICN ne devait pas être banalisée parce qu’elle s’observe chez des receveurs d’organes autres que le rein. «Nous savons que seule une petite proportion de transplantés rénaux bénéficient vraiment du passage d’un ICN à un inhibiteur de mTOR et que cette petite population n’est pas très bien définie. Il faut exclure tous les patients atteints d’une néphropathie primitive de même que tous les patients dont le DFGe est inférieur à 40 mL/min/1,73 m2, ce qui représente la majorité de nos patients en Allemagne, et si l’on a un patient présentant une protéinurie, il est probable que l’issue sera moins bonne sous inhibiteur de mTOR que sous inhibiteur de l’ICN. Les ICN ne sont pas la panacée pour l’immunosuppression des transplantés, certes, mais ils demeurent la meilleure option que nous ayons pour la majorité des patients.»
L’adhésion au traitement, essentielle à la prévention d’ASDdn
Si l’apparition d’ASDdn et l’éventuel rejet du greffon médié par les anticorps contribuent étroitement à la perte de greffon à long terme, toute stratégie visant à prévenir l’apparition d’ASDdn pourrait manifestement prolonger la survie à long terme du greffon. L’adhésion au traitement est cruciale. Selon Wiebe et al., qui ont associé la présence d’ASDdn à une différence de 40 % dans les taux de survie du greffon à 10 ans, le prédicteur le plus important de l’apparition d’ASDdn était la non-adhésion au traitement, comme en témoigne un risque relatif approché (OR) ajusté de 8,75 (p<0,001); venait ensuite l’incompatibilité au niveau de certains antigènes de classe 2 (OR 5,66, p<0,006). La non-adhésion au traitement est effectivement la cause de la perte d’allogreffon rénal dans environ la moitié de tous les cas de perte d’allogreffon rénal (Sellarés et al. Am J Transplant 2012;12[2]:388-99).
Résultats d’études
Malgré les conséquences possibles de la non-adhésion, l’adhésion au traitement est étonnamment médiocre chez de nombreux transplantés. Une étude publiée dans une revue de psychiatrie (Gen Hosp Psychiatry 2000;22[6]:412-24) a révélé que 20 à 50 % des transplantés n’adhéraient pas complètement à leur traitement immunosuppresseur. Parmi les raisons de la non-adhésion citées par les chercheurs figurent le type de médicaments prescrits, le nombre de médicaments et le nombre de doses par jour. Selon l’expérience d’un centre en particulier, l’observance est excellente au cours des premiers mois suivant la transplantation, mais elle se détériore considérablement avec le temps.
Tentant d’améliorer l’adhésion au traitement, le Dr Luca Toti, Università degli Studi di Roma Tor Vergata, Italie, et ses collègues (résumé MON.CO11.07) ont fait passer 82 transplantés hépatiques tacrolimus d’un schéma biquotidien à un schéma monoquotidien (préparation à libération prolongée) selon un rapport 1:1; aucun d’eux n’avait été traité pour un épisode de rejet avant le changement et tous avaient des fonctions hépatique et rénales stables. La transplantation hépatique avait eu lieu au moins 6 mois avant le changement de schéma, et les patients ont été suivis pendant au moins 24 mois.
Chez la majorité des patients, les concentrations moyennes de tacrolimus étaient significativement plus faibles 1 mois et 3 mois après le changement de schéma (4,4 ng/mL) qu’au départ (6,65 ng/mL). Après 24 mois, les concentrations de tacrolimus demeuraient plus faibles (5,1 ng/mL) chez les sujets recevant le schéma 1 fois/jour. «Malgré ces faibles concentrations, aucun impact sur les fonctions rénale ou hépatique n’a été observé», souligne le Dr Toti. La glycémie était aussi significativement plus faible 24 mois après le changement de schéma.
Fait peut-être encore plus important, les patients étaient plus nombreux à systématiquement suivre le traitement prescrit après le changement de schéma. Avant le changement, 78 % des patients ont affirmé avoir oublié de prendre leur médicament au moins une fois au cours des 4 semaines précédentes, et plus des deux tiers ont indiqué qu’ils avaient plus de mal à se souvenir de prendre la dose du soir. Après le changement, seulement 23 % des patients ont affirmé avoir oublié de prendre leur médicament au cours des 4 semaines précédentes. La satisfaction des patients était aussi élevée, seulement 5 patients ayant indiqué qu’ils ne voyaient aucun avantage à passer d’un schéma biquotidien à un schéma monoquotidien. «Cette étude semble indiquer que le changement de schéma est une bonne chose, sans compter que des concentrations plus faibles de tacrolimus après le changement de schéma pourraient aussi améliorer le profil de tolérabilité», conclut le Dr Toti.
Deux études monocentriques étayent les avantages du passage d’un schéma biquotidien de tacrolimus à un schéma monoquotidien chez des transplantés hépatiques. Dans l’étude de Volpes et al. (résumé MON.CO11.06), 186 transplantés stables sont passés d’un schéma de tacrolimus à libération immédiate 2 fois/jour à un schéma de tacrolimus à libération prolongée 1 fois/jour 3 ans (médiane) après la transplantation. Chez 166 des 186 patients, les concentrations minimales médianes étaient plus élevées avant le changement de schéma qu’après (6,3 ng/mL vs 4,5 ng/mL); en outre, la dose quotidienne totale moyenne de la préparation à une prise par jour a diminué tout au long de l’étude après le changement de schéma.
D’autres chercheurs (Giannelli et al., résumé TUE.MO15.02) ont évalué les concentrations minimales de tacrolimus (entre autres paramètres) chez 65 patients 1, 3, 6, 12 et 24 mois après un changement de schéma – de 2 fois/jour à 1 fois/jour – effectué 39 mois (médiane) après la transplantation. Les concentrations sanguines minimales se sont stabilisées chez 90 % des patients dans un délai de 45 jours après le changement; en outre, la fonction hépatique, la glycémie, le bilan lipidique et la tension artérielle sont demeurés stables au cours des 24 mois de suivi. Les concentrations sanguines minimales post-changement étaient là encore plus faibles qu’au départ, mais elles sont demeurées suffisantes pour assurer l’immunosuppression chez des transplantés hépatiques stables, fait remarquer le Pr Valerio Giannelli, Sapienza-Università di Roma. «Nous avons aussi observé une amélioration de la fonction rénale», ajoute-t-il, le DFGe étant passé de 71 mL/min/1,73 m2 au départ à 82 mL/min/1,73 m2 à 24 mois. «Si nous pouvons atténuer ou stabiliser les lésions rénales chez nos patients transplantés, c’est un atout.»
Kramer et al. (résumé WED.CO41.09), qui ont analysé une base de données regroupant près de 1300 transplantés rénaux, ont obtenu des résultats similaires. On a comparé chez des participants qui recevaient des schémas immunosuppresseurs semblables (exception faite de l’ICN) une préparation de tacrolimus à libération immédiate 2 fois/jour avec une préparation à libération prolongée 1 fois/jour. À 24 semaines, l’incidence des RACB était quasi identique dans les deux groupes : 13,9 % dans le groupe 1 fois/jour vs 14,1 % dans le groupe 2 fois/jour. Il en allait de même pour les pourcentages de patients ayant atteint le paramètre mixte (perte de greffon, RACB, perte au suivi) : 21,5 % vs 19,8 %, respectivement. Les pourcentages de patients ayant atteint le paramètre de l’Agence européenne des médicaments (perte de greffon, RACB, dysfonctionnement rénal) étaient également comparables : 40,3 % vs 38,3 %, respectivement.
Les chercheurs ont conclu des résultats de cette vaste base de données sur les transplantés rénaux que la préparation de tacrolimus à libération prolongée était non inférieure à la préparation à libération immédiate.
Résumé
La pénurie d’organes est actuellement la plus grande difficulté à laquelle se heurte la médecine de la transplantation. Entretemps, les médecins doivent optimiser l’utilisation des organes qu’ils reçoivent et offrir le traitement immunosuppresseur le plus efficace possible afin de préserver la capacité fonctionnelle du greffon à long terme. Il semble maintenant que le schéma le plus efficace soit celui auquel le patient peut adhérer systématiquement. Notre priorité devrait donc être de mettre au point des stratégies qui permettent d’améliorer l’adhésion au traitement.