Comptes rendus
Spondylarthrites : l’interleukine-17a est impliquée dans la physiopathologie
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PRESSE PRIORITAIRE - Congrès 2015 de l’American College of Rheumatology (ACR)
San Francisco, Californie, États-Unis / 6-11 novembre 2015
San Francisco - La pathogenèse des spondylarthrites telles que l’arthrite psoriasique (AP) et la spondylarthrite ankylosante (SA) repose sur des interactions complexes entre divers médiateurs immunologiques, dont l’interleukine (IL)-17a. Les spondylarthrites diffèrent de la polyarthrite rhumatoïde sur le plan de la pathogenèse et des manifestations cliniques, mais ces maladies se ressemblent quant au fardeau de morbidité qu’elles entraînent, en particulier la douleur et l’incapacité. Il a été démontré que le traitement anti-IL-17a améliorait les signes et les symptômes, la capacité fonctionnelle physique et la qualité de vie chez des patients atteints d’AP et de SA et que ces améliorations se maintenaient à long terme.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
Les spondylarthrites – qui forment un groupe de maladies inflammatoires génétiquement liées – regroupent notamment l’arthrite psoriasique (AP) et la spondylarthrite ankylosante (SA). Même si ces maladies évolutives et débilitantes nuisent considérablement à la capacité fonctionnelle et à la qualité de vie, il n’est pas rare qu’elles échappent au radar dans la pratique clinique.
La physiopathologie des spondylarthrites repose sur la production par des cellules immunitaires pro-inflammatoires de cytokines – dont une cruciale, l’interleukine(IL)-17 – qui permettent d’activer les récepteurs extracellulaires localisés sur les cellules cibles. L’activation de ces récepteurs est à l’origine des manifestations cliniques des spondylarthrites, dont la prolifération osseuse, la destruction du cartilage, l’érosion osseuse, l’enthésite et la synovite.
L’IL-17a et le facteur de nécrose tumorale (TNF)-alpha agissent en synergie à la surface des cellules afin de réguler l’inflammation chronique, affirme le Dr Mark Genovese, directeur de la clinique de rhumatologie, Stanford University, Palo Alto, Californie. La signalisation de l’IL-17a est responsable du processus d’inflammation articulaire et de destruction de la matrice caractéristique de l’AP.
En présence d’AP, une augmentation du nombre de cellules productrices d’IL-17a s’observe dans les articulations synoviales (membrane et liquide) alors qu’en présence de SA, l’augmentation s’observe dans le sang périphérique. Dans les facettes vertébrales, on observe également une augmentation du nombre de précurseurs myéloïdes et de neutrophiles producteurs d’IL-17.
L’atteinte cutanée et articulaire associée à l’AP est hétérogène
«Le tableau clinique de l’AP varie d’un patient à l’autre», explique la Pre Lauren Coates, clinicienne et maître de conférences en rhumatologie, University of Leeds, Angleterre. Les aspects cliniques de l’AP de même que ses manifestations cutanées et articulaires sont hétérogènes.
«Chez la majorité des patients, l’apparition de lésions cutanées et unguéales précède celle de l’AP», poursuit la Pre Coates.
L’atteinte articulaire découlant de l’AP évolue avec le temps. Selon les données issues de l’Early Arthritis Cohort, 27 % des patients atteints d’AP débutante présentaient au moins une érosion lorsqu’ils se sont présentés à la clinique; 2 ans plus tard, la maladie était érosive malgré un traitement actif en clinique chez 47 % des patients.
«Chez de nombreux patients, on observe un intervalle entre l’apparition des symptômes et le diagnostic», dit-elle. Un intervalle de plus de 6 mois – comparativement à un intervalle de moins de 6 mois – a d’importantes répercussions négatives sur l’issue à court et à long terme, notamment sur le plan des érosions, de la capacité fonctionnelle et de la réponse au traitement durant le suivi.
«En clinique, nous avons de plus en plus souvent recours à l’imagerie pour le diagnostic et la surveillance de l’AP. Nous savons que la radiographie traditionnelle permet de détecter les caractéristiques typiques de l’AP, mais ces caractéristiques apparaissent généralement beaucoup plus tard au cours du processus morbide. Comme nous aspirons à poser le diagnostic avant la survenue d’érosions [...], nous utilisons maintenant beaucoup plus souvent des techniques d’imagerie plus performantes, l’échographie et l’imagerie par résonance magnétique (IRM) en particulier.»
Comme c’est le cas pour la polyarthrite rhumatoïde, l’échographie est utile pour la détection d’une activité inflammatoire au niveau du rachis, des articulations et des enthèses de même que pour la surveillance de la maladie. L’IRM permet quant à elle une visualisation directe de l’inflammation au niveau des articulations périphériques et axiales ainsi que des enthèses.
Chez une importante proportion de patients psoriasiques qui consultent en dermatologie, l’AP est présente sans pour autant avoir été diagnostiquée.
Le PEST (Psoriasis Epidemiology Screening Tool) – outil de dépistage en 5 questions appelant un simple oui ou non comme réponse – aide à poser tôt un diagnostic d’AP chez les patients atteints de psoriasis. En présence de trois réponses positives, la sensibilité du questionnaire pour l’AP se situe entre 75 et 80 % et sa spécificité, entre 40 et 50 %.
Traitement dirigé contre l’IL-17a
On s’est penché en clinique sur les agents dirigés contre l’IL-17a pour le traitement de l’AP et de la SA parce que ce ne sont pas tous les patients qui répondent adéquatement aux inhibiteurs du TFN ou les tolèrent bien. Il a été démontré que le sécukinumab, anticorps monoclonal IgG1k anti-IL-17a humain, améliorait les signes et les symptômes de ces maladies, la capacité fonctionnelle physique et la qualité de vie, et que ces améliorations étaient durables.
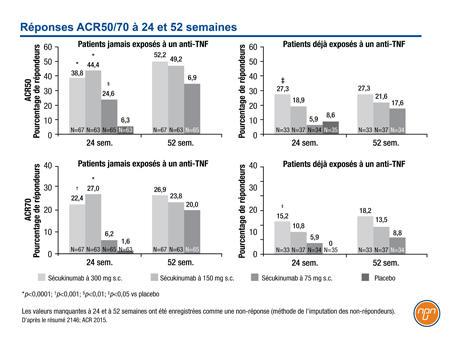
L’analyse d’un sous-groupe de l’étude de phase III FUTURE 2 menée à double insu avec randomisation a révélé que, comparativement à un placebo, le sécukinumab administré à raison de 150 mg ou de 300 mg par voie sous-cutanée avait été associé à une amélioration durable des signes et des symptômes de l’AP, de la capacité fonctionnelle et de la qualité de vie chez des patients qui n’avaient jamais reçu d’inhibiteur du TNF ou qui, au contraire, y avaient été exposés, souligne le Dr Arthur Kavanaugh, University of California, San Diego, Californie. La réponse clinique au sécukinumab était généralement plus marquée chez les patients n’ayant jamais reçu d’inhibiteur du TNF. Au sein de ce sous-groupe, par exemple, on a observé à 52 semaines une réponse ACR20 (amélioration de 20 % selon les critères de l’American College of Rheumatology) chez 79,4 % des patients sous sécukinumab à 150 mg, 68,7 % des patients sous sécukinumab à 300 mg et 15,9 % des patients sous placebo. Au sein du sous-groupe des patients déjà exposés à un inhibiteur du TNF, les pourcentages étaient respectivement de 37,8 %, 54,5 % et 14,3%. Ces deux doses de sécukinumab ont été associées à une amélioration similaire de la réponse ACR50/70 à 52 semaines.
Une autre analyse de sous-groupe de l’étude FUTURE 2 a fait ressortir une amélioration de la fatigue sous sécukinumab chez des patients dont l’AP demeurait active malgré un traitement anti-TNF, précise la Pre Laure Gossec, Université Paris 6, Paris, France. En effet, à 16 semaines, la fatigue s’était améliorée d’au moins 4 points sur l’échelle FACIT-F (Functional Assessment of Chronic Illness Therapy-Fatigue) chez 52 à 71 % des patients traités par le sécukinumab.
Dans l’étude FUTURE 1, l’efficacité du sécukinumab en présence d’AP se maintenait toujours à 2 ans, selon les données présentées par le Dr Philip Mease, Centre médical suédois et University of Washington, Seattle, Washington. À 24 semaines, le sécukinumab était supérieur au placebo d’après le taux de réponse ACR20 (paramètre principal), et les patients pouvaient ensuite recevoir du sécukinumab en mode ouvert. À 104 semaines, 66,8 % des patients ayant reçu 150 mg de sécukinumab et 58,6 % des patients ayant reçu 75 mg de sécukinumab ont obtenu une réponse ACR20, comparativement à 50,0 % et à 50,5 % des patients à 24 semaines. D’autres aspects cliniques, comme la résolution des dactylites et des enthésites, le score HAQ-DI (Health Assessment Questionnaire Disability Index), la composante physique du SF-36 et la douleur associée à l’AP, de même que la progression radiographique se sont aussi améliorés grâce au traitement par l’inhibiteur de l’IL-17a.
Quelque 78,5 % des patients participaient toujours à l’étudeà 2 ans. Au sein du groupe sécukinumab, on avait signalé au terme des 104 semaines une rhinopharyngite chez environ 19 % des patients, une infection des voies respiratoires supérieures chez environ 19 % des patients, une dorsalgie chez 8,9 % des patients et une candidose non grave chez 2,4 % des patients.
À en juger par une analyse de sous-groupe de l’essai CLEAR regroupant des patients atteints à la fois de psoriasis et d’AP, les patients sous sécukinumab ont été plus nombreux à parvenir à une réponse PASI (Psoriasis Area and Severity Index) de 90 % à 16 semaines, mais la différence n’a pas atteint le seuil de significativité statistique (79,0 % vs 57,6 %; p=0,063) comparativement à l’ustekinumab, enchaîne la Dre Alice Gottlieb, Tufts Medical Center, Boston, Massachusetts. La proportion de patients ayant bénéficié d’une amélioration cliniquement significative du score HAQ-DI se chiffrait à 34,9 % dans le groupe sécukinumab et à 26,5 % dans le groupe ustekinumab.
Figure 1.