Comptes rendus
La chélation du fer associée à une prolongation de la survie dans diverses hémopathies
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
FRONTIÈRES MÉDICALES - 53e Assemblée/Exposition annuelle de l’American Society of Hematology
San Diego, Californie / 10-13 décembre 2011
San Diego - De nouvelles données présentées au congrès ont étoffé les données existantes montrant que la chélation du fer prolonge la survie chez les patients présentant des anomalies érythrocytaires. Les données sont particulièrement concluantes dans les syndromes myélodysplasiques (SMD), mais des études réalisées dans d’autres hémopathies, telle la thassalémie, montrent aussi que la chélation du fer a d’importantes retombées sur l’issue clinique. Dans la plupart des guides de pratique, on recommande de surveiller le taux de ferritine chez les patients atteints d’un SMD et dans d’autres groupes de patients recevant souvent des transfusions de concentrés érythrocytaires, mais de nouvelles données étayent une intensification de cette démarche. Certes, la chélation du fer ne remplace pas les traitements à visée curative comme la greffe de cellules souches lorsqu’ils sont indiqués, mais des données toujours plus nombreuses montrant que la chélation du fer prolonge la survie et améliore la qualité de vie font de cette approche le traitement de référence dans diverses hémopathies.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
Chez les patients ayant besoin de transfusions sanguines, qui apportent environ 250 mg de fer l’unité, une surcharge en fer apparaît rapidement. Or, des concentrations toxiques de fer peuvent porter atteinte au cœur, au squelette et au foie. Chez les patients ayant besoin de transfusions sanguines à répétition, y compris les patients atteints d’un syndrome myélodysplasique (SMD) ou d’un autre trouble de l’hématopoïèse, ainsi que chez les patients thalassémiques ou drépanocytaires, on doit diminuer les réserves de fer pour prévenir les complications. La chélation du fer – dont le rôle est établi dans nombre de ces maladies – est grandement simplifiée depuis l’avènement des chélateurs oraux.
Prolongation de la survie
Depuis que l’on sait que la chélation du fer est associée à une prolongation de la survie, on l’envisage avec plus d’empressement. «La surcharge en fer est associée à une atteinte cardiaque, hépatique et endocrinienne chez les patients atteints d’anémie chronique dont la survie dépend de transfusions de même qu’à une diminution de la survie dans certaines formes de cancer», confirme le Dr Roger Lyons, Cancer Care Centers of South Texas, San Antonio. «Nous savons que la dépendance aux transfusions altère l’issue clinique, y compris la survie, dans les SMD, mais les données selon lesquelles la chélation du fer pourrait améliorer la survie globale prouvent que les complications de la dépendance aux transfusions sont réversibles.»
Au nombre de ces données figurent celles d’un registre non interventionnel regroupant 600 patients myélodysplasiques à faible risque suivis dans 107 établissements américains que le Dr Lyons a présentées au congrès. Les patients considérés comme étant «à faible risque» selon la classification de l’Organisation mondiale de la Santé (OMS) et/ou le score IPSS (International Prognostic Scoring System) sont stratifiés en 3 groupes : sans chélation; chélation depuis <6 mois; chélation depuis =6 mois. Les données des 24 premiers mois de suivi (sur 60 prévus) sont maintenant disponibles. L’âge médian des patients est d’environ 75 ans et le ratio hommes:femmes – d’environ 1,3:1 – ne diffère pas significativement d’un groupe à l’autre.
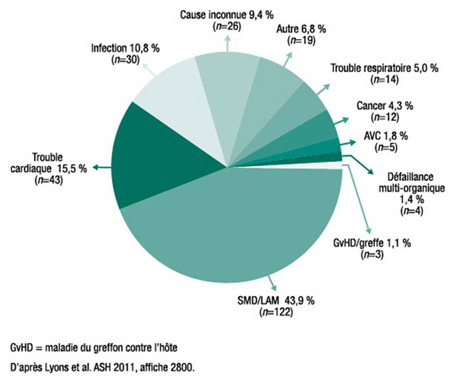
«La médiane de survie des patients des 3 sous-groupes – aucune chélation, chélation depuis <6 mois et chélation depuis =6 mois – se chiffre à 52,2, 99,3 et 104,4 mois, respectivement. La différence entre les deux groupes sous chélation et le groupe sans chélation était hautement significative sur le plan statistique [p<0,0001]», souligne le Dr Lyons. Bien que l’effectif ne soit pas assez important pour que l’on compare les différences quant aux causes de décès, près de 45 % des décès étaient imputables à un SMD ou à une leucémie aiguë myéloblastique (LAM) (Figure 1). Fait digne de mention, le pourcentage de patients dont la maladie a progressé vers une LAM était plus élevé dans le groupe sans chélation (8,9 %) que dans le groupe sous chélateur depuis <6 mois (4,6 %) et le groupe sous chélateur depuis =6 mois (5,2 %), mais les écarts n’ont pas atteint le seuil de significativité statistique.
«La tendance à la baisse de la progression vers la LAM dans les groupes sous chélation va dans le même sens que les données antérieures ayant objectivé une diminution de la survie sans leucémie chez les patients présentant une surcharge en fer», fait remarquer le Dr Lyons.
Figure 1. Causes de décès (N=278)
Au départ, 29,1 % des patients du registre étaient sous chélateur du fer : 25,2 % recevaient du déférasirox (chélateur oral), tandis que les autres patients recevaient de la déféroxamine (chélateur injectable). Au fil du suivi, le pourcentage de patients sous chélateur est passé à 37 %. Il importe ici de souligner que les taux sériques de ferritine étaient similaires dans les 3 groupes, même si le nombre médian d’unités de concentrés érythrocytaires (CE) transfusés administrés par période de 4 semaines était d’environ 2,1 chez les patients sous chélateur et de 1,5 chez les patients ne recevant aucun chélateur.
À ce jour, le suivi n’a objectivé aucune différence significative quant au taux de complications hépatiques ou endocriniennes, mais on a observé une tendance à la hausse des troubles cardiaques dans le groupe sans chélation, comparativement au groupe sous chélateur depuis =6 mois (46 % vs 39,8 %; p=0,167). «On s’attend à ce que l’examen continu des données du registre mette en lumière d’autres différences entre les groupes sous chélateur et le groupe sans chélation quant à l’issue clinique», affirme le Dr Lyons.
Prolongation de la survie chez les patients à faible risque selon le score IPSS
Au Canada, on a réalisé une étude rétrospective afin d’examiner le lien entre l’issue clinique et la chélation du fer chez 182 patients atteints d’un SMD considéré comme étant à faible risque selon la biopsie de moelle osseuse et le score IPSS. L’âge médian de ces sujets était de 70 ans et 60 % des sujets étaient de sexe masculin. Même si 75 % des sujets de cette étude recevaient des transfusions de CE, seulement 21 % recevaient un chélateur du fer. La durée médiane du suivi était légèrement supérieure à 2 ans et la durée médiane du traitement chélateur, de 10,5 mois.
Dans cette étude, dont les sujets myélodysplasiques étaient stratifiés selon qu’ils présentaient ou non une anémie réfractaire avec sidéroblastes (RARS), le bénéfice associé au chélateur du fer était concentré chez les sujets sans RARS. Au sein de ce groupe, le taux de survie à 5 ans était de 91,7 % chez les sujets sous chélateur du fer vs 39,2 % chez les sujets ne recevant pas de chélateur (p=0,04) (Figure 2). Chez les patients souffrant de RARS, la différence n’a pas atteint le seuil de significativité (76,3 % vs 72,4 %).
Figure 2. Courbe de survie des patients en fonction de la chélation du fer
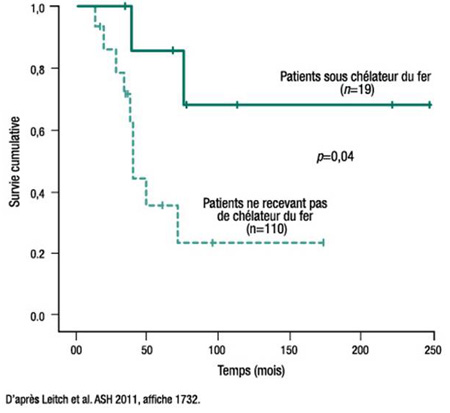
«Ces résultats – à l’instar de résultats antérieurs – évoquent un lien entre l’administration d’un chélateur du fer et la durée de survie chez les patients à faible risque selon le score IPSS. En particulier, le lien entre le traitement et la SG semble plus concluant en l’absence de RARS», explique la Dre Heather Leitch, St. Paul’s Hospital, University of British Columbia, Vancouver. Toutefois, prévient-elle, on ne peut pas tirer de solides conclusions, car le suivi n’est peut-être pas assez long pour confirmer un gain de survie à long terme associé au chélateur du fer chez les patients atteints de RARS. La Dre Leitch préconise la tenue d’un essai prospectif avec randomisation afin d’étayer la pertinence de l’utilisation grandissante de ce traitement.
Chez tous les patients dont la survie dépend de transfusions, le traitement chélateur du fer sera probablement associé à des bénéfices comparables en raison de l’apparition rapide d’une surcharge en fer dans tous les cas.
Délai de réponse et indépendance transfusionnelle
La Dre Daniela Cilloni, Università degli studi di Torino, Orbassano, Italie, a présenté au congrès une autre étude rétrospective multicentrique. Cette étude, dont l’effectif se composait de 105 patients atteints de diverses hémopathies, regroupait 6 établissements en Italie. Les hémopathies se répartissaient comme suit : 75 cas de SMD, 16 cas de myélofibrose primitive, 8 cas d’anémie aplasique, 4 cas de leucémie myélomonocytaire chronique et 2 cas de LAM. Parmi les 98 patients sous chélateur du fer, 68 recevaient du déférasirox et 30, de la déféroxamine. Au moment où le traitement a été amorcé, le nombre médian d’unités de concentrés érythrocytaires (CE) transfusés était de 30. Le paramètre principal le plus important était la réponse au chélateur du fer, dont l’accès à l’indépendance transfusionnelle.
«Sur le plan hématologique, les améliorations – tel un besoin moindre de transfusions de CE – étaient fréquentes. C’est donc dire que la chélation du fer donne lieu à une réponse érythroïde importante. Environ 20 % des patients de cette série sont parvenus à l’indépendance transfusionnelle», souligne la Dre Cilloni. On a pu mettre fin au traitement chélateur du fer chez 7 des 18 patients qui étaient parvenus à l’indépendance transfusionnelle, et la réponse s’est maintenue pendant une durée médiane de 12 mois après l’arrêt du traitement chez 4 d’entre eux.
La comparaison entre le déférasirox oral et la déféroxamine injectable a toutefois objectivé des différences quant au taux de réponse et à la probabilité globale de réponse. La médiane du délai de réponse, par exemple, était de 3 mois sous déférasirox vs 6 mois sous déféroxamine (p=0,001). En outre, 12 des sujets sous déférasirox vs 5 des sujets sous déféroxamine ont accédé à l’indépendance transfusionnelle (p=0,0003). Enfin, les patients sous déférasirox ont été significativement plus nombreux que les patients sous déféroxamine à bénéficier d’une augmentation du taux d’hémoglobine >1,5 mg/dL.
«On ne sait pas exactement pourquoi le déférasirox est associé à un taux de réponse plus élevé et à un délai de réponse plus court, mais la constance de ces résultats donne à penser qu’il pourrait y avoir des différences quant aux mécanismes moléculaires», conclut la Dre Cilloni.
Effets bénéfiques sur les organes cibles
Dans la thalassémie, la chélation du fer semble permettre au patient d’accéder à l’indépendance transfusionnelle. Lorsqu’il a présenté les résultats de l’étude de phase II THALASSA, le Dr Ali T. Taher, American University, Beyrouth, Liban, a expliqué que les patients thalassémiques développaient souvent une surcharge en fer en raison d’une absorption intestinale accrue du fer. Même chez les patients thalassémiques qui ne dépendent pas de transfusions, la surcharge en fer entraîne de graves complications au niveau de plusieurs organes, dont le foie, au fil du temps. THALASSA a été le premier essai prospectif à évaluer les effets bénéfiques de la chélation du fer au sein de cette population.
Dans le cadre de cette étude, 166 patients atteints de béta-thalassémie intermédiaire (n=95), d’alpha-thalassémie (n=22) ou de bêta-thalassémie-hémoglobinose E (n=49) ont été randomisés dans l’un ou l’autre des 4 groupes suivants : 5 mg/kg/jour de déférasirox ou placebo apparié; 10 mg/kg/jour de déférasirox ou placebo apparié. La dose pouvait passer à un maximum 20 mg/kg/jour chez les patients présentant une forte surcharge en fer. L’objectif principal était de comparer la concentration hépatique en fer (CHF) après 1 an de traitement, mais d’autres critères, dont la variation du taux sérique de ferritine et l’innocuité, ont aussi été évalués.
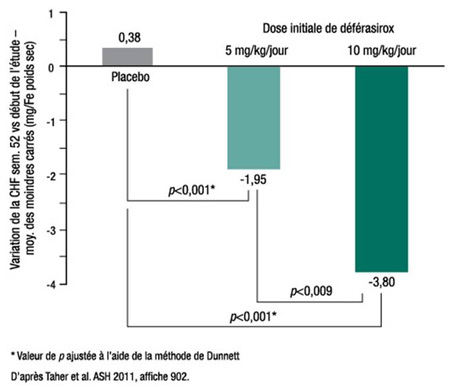
Au terme des 52 semaines de l’étude, la CHF avait augmenté de 0,38 mg de Fe/g poids sec dans les groupes placebo, alors qu’elle avait chuté de 1,95 mg Fe/g poids sec chez les patients recevant la dose de 5 mg/kg (p=0,001 vs placebo) et de 3,80 mg Fe/g poids sec chez les patients recevant la dose de 10 mg/kg (p<0,001) (Figure 3). La proportion de patients dont la CHF avait diminué d’au moins 30 % au cours des 52 semaines s’élevait à 1,8 % sous placebo, à 25,5 % sous déférasirox à 5 mg/kg et à 49,1 % sous déférasirox à 10 mg/kg. Ces variations concordent avec la variation du taux sérique de ferritine : augmentation de 115 ng/mL sous placebo vs diminution de 121 ng/mL (p<0,001 vs placebo) sous déférasirox à 5 mg/kg et de 222 ng/mL (p<0,001) sous déférasirox à 10 mg/kg.
«La diminution de la CHF était hautement significative sur le plan statistique, et la fréquence globale des effets indésirables était comparable à celle qu’on a observée sous placebo», affirme le Dr Taher. Compte tenu des risques associés à une CHF élevée persistante chez les patients thalassémiques qui ne dépendent pas de transfusions, on doit envisager la chélation du fer chez tous ces patients lorsque la CHF excède 5 mg Fe/g poids sec, conclut le Dr Taher.
Figure 3. THALASSA : Diminution de la concentration hépatique en fer
Les auteurs d’une autre étude présentée au congrès sur les risques cardiaques d’une surcharge en fer ont tiré les mêmes conclusions. Dans cette étude, 41 patients atteints de thalassémie majeure ont reçu du déférasirox à raison d’une dose moyenne de 26 mg/kg/jour pendant une médiane de 12 mois. Des données présentées par la Dre Elena Cassinerio, Ospedale Maggiore Policlinico, Milan, Italie, ont fait ressortir une amélioration statistiquement significative du T2* myocardique, ce dernier étant passé de 27,4 ms au départ à 29,8 ms au terme de l’étude (p=0,004). On a aussi observé une amélioration significative de la fraction d’éjection du ventricule gauche (de 63,6 à 65,5 % [p=0,013]), ce qui dénote une amélioration de la fonction cardiaque.
«Lorsque nous avons comparé les sujets dont la charge initiale en fer mesurée par le T2* était élevée [10-20 ms] avec ceux dont la charge initiale était plus faible [>20 ms], l’amélioration des volumes ventriculaires était d’autant plus marquée que la charge était élevée, mais le bénéfice était tout de même significatif chez les patients dont la charge était plus faible», précise la Dre Cassinerio. Bien que la durée du suivi des études visant à évaluer la diminution de la surcharge en fer dans les organes cibles ait été insuffisante pour que l’on puisse se prononcer quant à leur impact sur l’issue clinique, il est raisonnable de s’attendre à d’importantes retombées sur les événements subséquents. Chez les patients vulnérables dont la fonction cardiaque se détériore, une prolongation de la survie sera probablement au nombre des bénéfices.
Chez les patients atteints d’anémie aplasique, de nouvelles données semblent indiquer que le déférasirox pourrait aussi améliorer les paramètres hématologiques, car il réduit la surcharge en fer. Comme on l’a signalé dans l’étude EPIC, il a été associé à une diminution significative des taux sériques de ferritine. Selon une nouvelle analyse post hoc de 72 des 116 patients dont les paramètres hématologiques avaient été mesurés au départ et à la fin du traitement, 35 (48,6 %) avaient bénéficié d’une réponse hématologique au moins partielle. Cela dit, lorsqu’on s’est penché uniquement sur les 24 patients qui avaient reçu du déférasirox sans traitement immunosuppresseur, le taux de réponse s’élevait à 66,7 %; tous ces patients ont accédé à l’indépendance transfusionnelle.
«Chez les patients atteints d’anémie aplasique, tout comme chez les patients myélodysplasiques, le déférasirox pourrait non seulement diminuer la surcharge en fer, mais aussi améliorer les paramètres hématologiques», affirme le Dr Jong-Wook Lee, St. Mary’s Hospital, Séoul, Corée du Sud. À la lumière de ces données et d’autres données, il estime qu’une «diminution de la surcharge en fer pourrait contribuer à induire une réponse hématologique».
Résumé
L’administration d’un chélateur du fer peut infléchir le cours des hémopathies, notamment des troubles de l’hématopoïèse qui nécessitent de fréquentes transfusions sanguines. Des données recueillies prospectivement dans le cadre d’un registre regroupant 600 patients atteints d’un SMD à faible risque ont objectivé un lien concluant entre la chélation du fer et une prolongation de la survie et ont modifié la pratique dans un grand nombre d’établissements. La commercialisation de chélateurs du fer oraux facilite grandement le processus. Fait digne de mention, les chélateurs du fer actuellement sur le marché sont bien tolérés et sont associés à un faible risque d’effets indésirables.
Questions et réponses
Les questions et réponses qui suivent sont tirées d’un entretien avec la Dre Heather Leitch, St. Paul’s Hospital, University of British Columbia, Vancouver.
Q : Les nombreuses données qui étayent le recours à la chélation du fer dans diverses maladies, dont les SMD, semblent très concluantes. Pour quelles raisons la chélation du fer n’est-elle pas devenue le traitement de référence?
R : Beaucoup d’établissements optent systématiquement pour la chélation du fer, mais le manque d’essais multicentriques avec randomisation est un obstacle à son utilisation généralisée. De plus en plus de données montrent que la chélation du fer est salutaire, mais des études s’imposent même si cette conclusion semble évidente au vu des risques connus de la surcharge en fer dans les SMD et d’autres maladies. Des études sont d’ailleurs en cours de préparation.
Q : La surcharge en fer n’a rien de bien nouveau. Pourquoi n’a-t-on jamais fait d’essais?
R : La difficulté d’administration des traitements est l’une des raisons. Pendant des années, on a eu recours aux saignées pour diminuer la surcharge en fer; or, non seulement cette technique pose-t-elle des difficultés, mais elle est contre-indiquée chez les patients aux prises avec un trouble de l’hématopoïèse. La commercialisation de la déféroxamine a été un pas dans la bonne direction, mais c’est un agent injectable, ce qui complique la tâche des patients qui en ont besoin à long terme. La commercialisation d’un agent oral a suscité beaucoup d’enthousiasme dans le domaine. Plusieurs agents ont été mis au point. [Au Canada, seul le déférasirox est offert. Aux États-Unis, la défériprone est aussi commercialisée depuis octobre 2011.]
Q : La survie est l’un des critères de votre étude. En fait de paramètre concluant, on ne peut pas trouver mieux.
R : Comme nos données concordent avec les résultats de plusieurs études publiées, nous estimons qu’elles sont très concluantes. Mais, on le sait, les analyses rétrospectives ont d’importantes lacunes, alors force nous est de conclure que nos résultats ne sont que générateurs d’hypothèses. Je précise toutefois que, dans l’établissement où j’exerce, nous prescrivons maintenant un chélateur du fer aux patients atteints d’un SMD à faible risque et je sais que de nombreux autres établissements font de même. Cela dit, nous avons besoin de données prospectives pour tirer de solides conclusions.