Comptes rendus
Infection invasive à méningocoque chez les nourrissons : immunogénicité et innocuité d’un vaccin multicomposants innovant contre le méningocoque de sérogroupe B
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
MEDI-NEWS - D’après Lancet 2013;381(9869):825-35.
Au Canada, le méningocoque de sérogroupe B (menB) est devenu la principale cause d’infection invasive à méningocoque (IIM),
et les nourrissons sont très majoritairement atteints, d’où l’importance d’un vaccin efficace pour ce groupe d’âge vulnérable. Un vaccin multicomposants contre le menB a été évalué au sein d’une vaste cohorte de nourrissons; les résultats ont montré que ce vaccin était immunogène chez les nourrissons de 2 mois ou plus et qu’il ne nuisait pas de façon significative à l’immunogénicité des autres vaccins usuels de l’enfance administrés en concomitance. La réponse immunitaire a été robuste, tant à la série de doses de primovaccination qu’à la dose de rappel administrée à 12 mois. Le taux de consultation médicale pour cause de fièvre – laquelle survient généralement 6 heures après la vaccination – était faible. L’étude montre que le nouveau vaccin multicomposants est immunogène au sein de la population la plus vulnérable aux IIM de sérogroupe B.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
Le méningocoque de sérogroupe B, l’un des cinq principaux sérogroupes à l’origine d’infections invasives à méningocoque (IIM), touche très majoritairement les nourrissons, et c’est maintenant la cause la plus fréquente de méningite bactérienne et de septicémie en Europe et au Canada chez les nourrissons. En 2007, le Comité consultatif national de l’immunisation (CCNI) déclarait que plus de 80 % des IIM chez les nourrissons de moins de 1 an avaient été causées par le méningocoque de sérogroupe B (menB) (Mise à jour sur l’utilisation des vaccins conjugués quadrivalents contre le méningocoque. Relevé des maladies transmissibles au Canada, janvier 2013; vol. 39, DCC-1). Le menB est associé à l’incidence la plus élevée d’IIM au Canada, et ce sont principalement les enfants de <1 an qui sont touchés. (Bettinger et al. PIDJ. 2013;32[1]: e20-e25). Les vaccins actuellement sur le marché n’offrent aucune protection contre le menB, de sorte qu’il demeure impossible d’alléger le fardeau de morbidité rattaché aux infections causées par le méningocoque de ce sérogroupe.
Le procédé traditionnel – la conjugaison à un polysaccharide – que l’on a utilisé contre les méningocoques de sérogroupe A, C, Y et W-135 n’a pas pu être utilisé pour la mise au point d’un vaccin anti-menB parce que la capsule polysaccharidique propre à ce sérogroupe ressemble étroitement aux molécules d’adhésion des cellules neurales (NCAM) chez l’humain, ce qui rend le vaccin peu immunogène.
À l’aide d’une technique dite de «vaccinologie inverse», les scientifiques ont fini par repérer trois antigènes recombinants primaires qu’ils ont jugés appropriés pour un vaccin contre le menB : fHbp (factor-H-binding protein), NadA (Neisserial adhesin A) et NHBA (Neisserial heparin-binding antigen). Les premières études ont montré que ces antigènes, combinés à des fragments de vésicule de membrane externe (OMV) d’une souche de menB responsable d’une flambée d’IIM en Nouvelle-Zélande, étaient bactéricides in vitro. Ce vaccin multicomposants contre le menB (4CMenB) est le premier vaccin anti-menB qui soit conçu pour cibler différentes souches de menB dans le monde.
Le programme de recherche clinique à l’appui de l’innocuité, de la tolérabilité et de l’immunogénicité du 4CMenB regroupait 13 essais cliniques et plus de 7800 sujets de tout âge, plus précisément : 5850 nourrissons et jeunes enfants et 1712 adolescents et adultes. Lors d’un essai pivot de phase III, le 4CMenB a été administré aux nourrissons à l’âge de 2, 4 et 6 mois, et on leur donnait une dose de rappel à 12 mois. De plus, on l’a administré avec ou sans vaccins usuels de l’enfance afin de s’assurer que ces derniers demeuraient immunogènes. Au total, 3630 nourrissons ont participé à l’essai : 2627 ont été randomisés dans une étude secondaire ouverte sur l’immunogénicité et 1003, dans une étude secondaire sur l’innocuité où les observateurs ignoraient le schéma reçu.
Parmi les sujets randomisés dans l’étude sur l’immunogénicité, 1968 ont reçu à la fois le 4CMenB et les vaccins usuels de l’enfance et 659, uniquement les vaccins usuels de l’enfance. Dans l’étude secondaire sur l’innocuité, 533 nourrissons ont reçu à la fois le 4CMenB et les vaccins usuels de l’enfance et 490, les vaccins usuels de l’enfance et le vaccin contre le méningocoque de sérogroupe C.
Les parents dont le nourrisson avait reçu toutes les doses de primovaccination dans l’étude sur l’immunogénicité ou l’innocuité du 4CMenB ont été invités à inscrire leur enfant à la phase suivante pour que ce dernier reçoive une dose de rappel à 12 mois. Lors de cette deuxième étape, les enfants recevaient soit le 4CMenB seul en dose de rappel à 12 mois (n=789), soit en concomitance avec le vaccin rougeole-oreillons-rubéole-varicelle (RORV) (n=766).
Le dosage de l’activité bactéricide du sérum à l’aide de complément humain (hSBA) – qui permettait de déterminer l’immunogénicité du vaccin contre les souches testées de menB – a révélé qu’un titre hSBA ≥5 était corrélé avec un effet protecteur.
Immunogénicité et innocuité
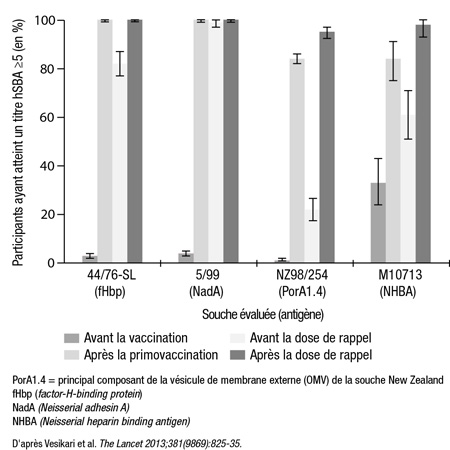
Comme l’ont souligné Vesikari et al. (The Lancet 2013;381[9869]:825-35), 100 % des nourrissons ont atteint des titres hSBA ≥5 contre les antigènes fHbp, NadA et NHBA 1 mois après avoir reçu les trois doses du vaccin, alors que 84 % ont atteint le même titre hSBA contre l’OMV de la souche New Zealand (Figure 1). On a testé a posteriori la réponse à la souche NHBA dans un sous-groupe de 100 nourrissons, et 84 % ont obtenu un titre hSBA ≥5. Comme le soulignent les auteurs, la réponse anticorps aux différentes souches s’était atténuée à l’âge de 12 mois.
Après l’administration d’une dose de rappel du 4CMenB seule ou en concomitance avec le vaccin RROV, les chercheurs ont observé une réponse secondaire qui s’est manifestée par l’obtention de titres hSBA ≥5 contre les 4 antigènes vaccinaux chez 95 à 100 % des sujets vaccinés. À l’exception de la réponse des nourrissons au poliovirus de type 2, le taux de réponse immunologique vis-à-vis de tous les antigènes vaccinaux était acceptable lorsque les vaccins usuels étaient administrés en concomitance avec le 4CMenB.
Figure 1. Nourrissons ayant atteint des titres hSBA ≥5
Sur le plan de l’innocuité, les données groupées pour toutes les doses combinées ont indiqué que l’incidence des réactions au point d’injection avait atteint un maximum le 1er jour, mais qu’elle avait chuté brusquement le 2e jour et qu’elle était comparable, que les nourrissons aient reçu le 4CMenB seul ou en concomitance avec les vaccins usuels de l’enfance. Après l’administration de la dose de rappel du 4CMenB, l’incidence des réactions au point d’injection a été beaucoup plus faible. La fièvre a été la réaction systémique la plus fréquente, tant chez les nourrissons que chez les enfants de 12 mois, et elle survenait le plus souvent 6 heures après la vaccination, que le vaccin ait été administré seul ou en concomitance avec les vaccins usuels de l’enfance.
Le traitement de la fièvre a nécessité peu de consultations médicales (2 à 3 % des doses). Le besoin d’intervention médicale a été encore plus faible lorsque le 4CMenB était administré en concomitance avec les vaccins usuels de l’enfance (1 % des doses), comparativement à 1,1 % lorsque les vaccins usuels étaient administrés seuls et 1 % lorsque les vaccins usuels étaient administrés en concomitance avec le vaccin contre le menC. Après la dose de rappel, les taux de fièvre ne différaient pas chez les nourrissons selon que le 4CMenB avait été administré seul ou en concomitance avec le vaccin RORV.
Considérations futures
Dans un éditorial qu’ils signent, le Dr Matthew Snape, Groupe de vaccinologie d’Oxford, University of Oxford, et le Dr Andrew Pollard, NIHR Oxford Biomedical Research Centre, Royaume-Uni, se demandent si l’avènement du 4CMenB n’est pas «le début de la fin» des IIM imputables au Neisseria meningitidis de sérogroupe B. La rareté relative des IIM causées par le menB signifie que le vaccin doit être homologué sur la foi de titres bactéricides d’anticorps contre les souches vaccinales plutôt que sur la foi de données prouvant directement la prévention des IIM de sérogroupe B.
Les médecins peuvent à tout le moins compter sur l’efficacité partielle du vaccin, car l’un des quatre composants du vaccin est identique à celui que contient le vaccin anti-menB néozélandais qui a permis de circonscrire une flambée d’IIM imputables à un clone de menB en Nouvelle-Zélande, soulignent les deux éditorialistes.
La même souche de menB circule aussi en Europe depuis une vingtaine d’années. La proportion de souches de menB sensibles au 4CMenB demeure inconnue. Comme l’ont rapporté Donnelly et ses collaborateurs en 2011 lors de la 11e Assemblée de la European Meningococcal Disease Society en Slovénie, les réponses immunitaires au vaccin donnent tout lieu de croire que le 4CMenB préviendra 77,5 % des IIM causées par le menB dans cinq pays européens. Si ces estimations sont exactes, nous pouvons conclure à la maîtrise des IIM, affirment les auteurs.
Pour les chercheurs qui s’acharnent depuis 40 ans à mettre un vaccin au point contre le menB, l’homologation imminente du 4CMenB est une réelle percée scientifique, affirment les auteurs.
Dans une interview, le Dr Ronald Gold, professeur émérite de pédiatrie, University of Toronto, Ontario, a déclaré : «C’est un vaccin très prometteur. Il est associé à des titres d’anticorps que nous pouvons qualifier de protecteurs dans tous les groupes d’âge à partir de l’âge de 2 mois.»
Comme l’a montré l’étude de Vesikari et al., le 4CMenB injecté séparément peut être donné en concomitance avec les vaccins usuels de l’enfance sans nuire à leur immunogénicité. De même, l’administration concomitante du 4CMenB et des vaccins usuels de l’enfance ne modifie pas le profil de réactogénicité du 4CMenB ni celui d’autres vaccins, et les études montrent que les effets indésirables ne requièrent pas plus de consultations médicales lorsque le 4CMenB est administré avec les autres vaccins.