Comptes rendus
La chélation du fer en hématologie : nouvelles données sur les thalassémies et les syndromes myélodysplasiques sans dépendance transfusionnelle
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
FRONTIÈRES MÉDICALES - 17e Congrès de la European Hematology Association
Amsterdam, Pays-Bas / 14-17 juin 2012
Amsterdam - La surcharge en fer est une complication de diverses hémopathies. Elle est principalement associée à la dépendance transfusionnelle, mais elle peut également découler du processus morbide en tant que tel, notamment dans les thalassémies sans dépendance transfusionnelle (TSDT). Il est maintenant établi que ces patients ont une charge en fer comparable à celle des patients atteints de thalassémie majeure avec dépendance transfusionnelle. Chez les patients souffrant d'un syndrome myélodysplasique (SMD) avec dépendance transfusionnelle, les données à l'appui des bénéfices associés à la chélation du fer continuent de s'accumuler. De nouvelles données semblent indiquer que la chélation du fer pourrait modifier l'évolution des SMD du fait qu'elle augmente la probabilité de réponse hématologique, mais d'autres études s'imposent pour confirmer cette hypothèse fascinante.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
Le syntagme générique «thalassémie sans dépendance transfusionnelle» (TSDT) s’applique à plusieurs thalassémies où les patients n’ont pas besoin de transfusions sanguines régulières. Des transfusions s’imposent toutefois dans certaines situations, par exemple en l’absence de croissance chez un enfant, durant la grossesse ou en présence d’une infection. Il y a trois grandes formes de TSDT : l’hémoglobinose H (HbH), la HbE/bêta-thalassémie et la bêta-thalassémie intermédiaire. Malgré les progrès des méthodes diagnostiques biologiques et moléculaires, le diagnostic repose principalement sur la présence de signes cliniques, et la maladie est parfois difficile à reconnaître. Une forme légère peut être asymptomatique pendant de longues périodes et passer inaperçue jusqu’à l’âge adulte. Les formes plus sévères se manifestent durant l’enfance. Un diagnostic exact est vital, faute de quoi un enfant peut se voir prescrire des transfusions à vie inutilement.
«L’expression clinique d’une TSDT découle d’une érythropoïèse inefficace, d’une hémolyse et d’une surcharge en fer», affirme le Dr Bart Biemond, Academic Medical Center, Amsterdam, Pays-Bas. Les symptômes sont notamment une anémie, une hématopoïèse extramédullaire, une splénomégalie et les manifestations d’une hémolyse chronique telles qu’ulcère de jambe, ictère, hypertension pulmonaire et événements thrombo-emboliques. La surcharge en fer – qui s’explique par une hématopoïèse inefficace et l’absorption intestinale accrue de fer – entraîne des troubles endocriniens et hépatiques. Chez les enfants, la combinaison de troubles endocriniens liés à la surcharge en fer et des effets de l’anémie peut donner lieu à une petite taille et retarder le développement pubertaire.
«Les complications des TSDT s’accentuent avec l’âge», note le Dr Ali Taher, American University of Beirut Medical Center, Liban. La charge en fer – qui augmente aussi avec le temps – influe sur la morbidité, en effet, un taux sérique élevé de ferritine est un facteur de risque d’événement thrombo-embolique, et l’hypertension pulmonaire est corrélée avec la concentration hépatique en fer (CHF). Les patients atteints de bêta-thalassémie intermédiaire peuvent, à défaut d’être traités, développer une surcharge hépatique en fer sévère. «À âge égal, ces patients ont une CHF comparable à celle de patients atteints de thalassémie majeure transfusés», explique le Dr Taher.
Les transfusions sanguines sont bénéfiques chez de nombreux patients, mais elles contribuent à augmenter la charge en fer. Chez les jeunes patients, elles visent à supprimer l’activité de la moelle osseuse, ce qui favorise la croissance et diminue l’absorption intestinale de fer. On croit en outre que les transfusions sanguines protègent contre un grand nombre de complications tardives des TSDT.
Chélation du fer dans les TSDT
«La dépendance transfusionnelle varie grandement : dans certains cas, des transfusions ne sont jamais requises alors que dans d’autres, la dépendance est quasi totale», fait remarquer la Pre Maria Domenica Cappellini, Università degli studi di Milano, Italie. «Chez les patients atteints de TSDT, on doit toujours être à l’affût d’une surcharge en fer», insiste-t-elle. On doit les surveiller de plus près que les patients atteints de thalassémie majeure, car ils ne reçoivent pas chaque mois un apport en fer prédéterminé.
Les experts ne s’entendent pas sur le moment idéal pour amorcer le traitement chélateur. Dans les guides de pratique antérieurs, on proposait le seuil d’une CHF ≥7 mg/g poids sec, mais nous savons maintenant que ce seuil définit en fait l’apparition de complications, affirme la Pre Cappellini. La recommandation devra donc être modifiée. Lors d’une étude publiée récemment, le Dr Taher et son équipe ont constaté que la chélation du fer conférait une protection contre l’hypertension pulmonaire, l’hypogonadisme, l’ostéoporose et la cholélithiase (Blood 2010;115[10]:1886-92).
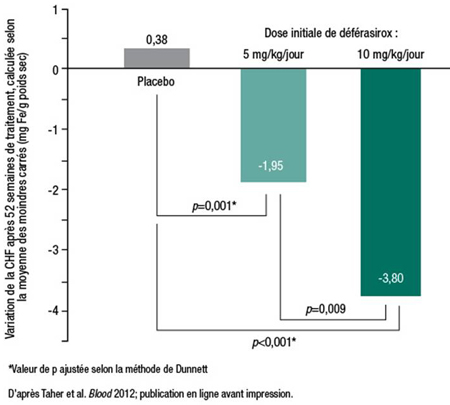
L’efficacité et l’innocuité de la chélation du fer par le déférasirox dans les TSDT ont été évaluées dans le cadre de l’essai THALASSA (Taher et al. Blood 2012; publication en ligne avant impression), dont les résultats ont été divulgués en décembre 2011. L’essai THALASSA regroupait 166 patients de 10 ans ou plus atteints de TSDT avec une CHF ≥5 mg Fe/g poids sec et un taux sérique de ferritine >300 ng/mL. «Nous avons été étonnés de voir à quel point la CHF initiale était élevée chez ces patients», fait remarquer la Pre Cappellini. Cette observation est d’autant plus étonnante que les sujets ayant besoin de transfusions régulières étaient exclus de l’étude. Les patients étaient randomisés de façon à recevoir une dose initiale de 5 ou 10 mg/kg/jour ou un placebo d’apparence similaire. La CHF a diminué significativement de 3,8 mg/g poids sec par rapport à la valeur initiale sous l’effet d’une dose initiale de 10 mg/kg/jour, alors qu’elle a augmenté de 0,38 mg/g poids sec chez les patients sous placebo (p<0,001) (Figure 1). Les effets indésirables étaient similaires dans les groupes recevant le traitement actif et le groupe placebo. Les effets indésirables les plus fréquents étaient les éruptions cutanées et les troubles digestifs, lesquels pouvaient être traités.
Figure 1. THALASSA : Effet de la chélation du fer par le déférasirox sur la CHF chez des patients atteints de TSDT
Prise en charge des TSDT : traitement et surveillance
Comment doit-on prendre les TSDT en charge dans la pratique clinique? La grande variabilité de la sévérité et de l’expression clinique de ces thalassémies rend difficile l’élaboration de recommandations thérapeutiques claires, enchaîne la Pre Cappellini. Parmi les options de traitement figurent la splénectomie, l’induction de synthèse de l’hémoglobine fœtale (HbF) à l’aide d’hydroxyurée, les transfusions sanguines et la chélation du fer. La splénectomie est maintenant moins fréquente vu le risque accru de complications chez les splénectomisés. L’induction de la synthèse d’HbF est controversée, car le traitement doit se poursuivre la vie durant, mais il pourrait prémunir le patient contre les complications.
Une chose est claire cependant : les patients atteints d’une TSDT doivent être surveillés de près à intervalles réguliers. Le Pr Antonis Kattamis, Université d’Athènes, Grèce, a fait une allocution sur la surveillance des patients atteints de TSDT. La surveillance vise un triple objectif, car on doit être à l’affut d’une anémie, des complications de la maladie et d’une surcharge en fer. «Il y a plusieurs façons de mesurer la surcharge totale en fer, et chacune a ses avantages et ses désavantages», explique le Pr Kattamis. La mesure de la CHF par l’IRM est devenue la norme dans les thalassémies, mais la CHF peut aussi être mesurée au moyen d’une biopsie ou par SQUID (superconducting quantum interference device). Le degré de corrélation entre la ferritine sérique et la CHF varie selon la maladie sous-jacente, note-t-il. Dans la bêta-thalassémie intermédiaire, on obtient une sous-estimation de la CHF. L’équipe du Dr Taher a présenté au congrès une nouvelle analyse selon laquelle un taux sérique de ferritine >800 ng/mL est fortement prédictif d’une CHF ≥5 mg/g poids sec chez des patients atteints de TSDT; c’est donc dire que le dosage sérique de la ferritine pourrait être fort utile comme outil de surveillance.
Chez les patients atteints de TSDT, le taux sérique de ferritine doit être mesuré tous les 6 à 12 mois, estime le Pr Kattamis. La CHF doit être mesurée au moins une fois en présence de signes de surcharge en fer, puis une fois par année ou tous les 2 ans par la suite. La mesure de la saturation en fer de la transferrine, celle du fer non lié à la transferrine (NTBI) et celle du fer plasmatique labile (LPI) demeurent expérimentales.
Syndromes myélodysplasiques
Les SMD peuvent survenir à n’importe quel âge, mais ils frappent surtout les patients de 70 ans ou plus. Le choix du traitement dépend du score pronostique, les patients étant généralement considérés comme étant à faible risque (catégories IPSS [International Prognostic Scoring System] faible et intermédiaire-1) ou à risque élevé. L’âge avancé de la population et, en conséquence, le taux élevé de comorbidité expliquent en partie le manque d’études comparatives avec randomisation sur la chélation du fer dans les SMD, note le Pr Theo de Witte, Centre médical universitaire St-Radboud, Nimègue, Pays-Bas.
Malgré le recours à des traitements de fond et, au besoin, à des agents antianémiques, environ 85 % des patients finissent par développer une dépendance transfusionnelle et deviennent ainsi vulnérables à une surcharge en fer. Les stratégies visant à traiter la surcharge en fer sont particulièrement importantes dans les SMD à faible risque, car les patients sont typiquement transfusés à intervalles réguliers pendant un certain nombre d’années.
Le point sur le registre de l’Union européenne sur les SMD
Nos connaissances sur les effets toxiques du fer sur l’issue clinique chez les patients atteints d’un SMD proviennent en grande partie de registres. Le registre de l’Union européenne (UE) sur les SMD – qui a été mis sur pied par le European LeukemiaNet – est une nouvelle source fiable de données prospectives sur 1000 patients à faible risque de 14 pays européens. En ciblant uniquement des patients dont le diagnostic est récent, ce registre évite le biais de sélection. Les données recueillies concernent surtout l’épidémiologie et la prise en charge de la maladie, mais on y trouve aussi des données sur le lien entre l’issue clinique et la dépendance transfusionnelle, la surcharge en fer et la chélation du fer. Le Pr de Witte a présenté au congrès des données publiées récemment sur les 18 premiers mois de suivi.
Chez les patients qui présentaient une dépendance transfusionnelle (29 % de l’effectif), le taux de mortalité à 18 mois était significativement plus élevé (21 % vs 5 % chez les sujets sans dépendance transfusionnelle, p<0,0001). En outre, parmi les patients atteints d’un SMD avec dépendance transfusionnelle, le taux de mortalité était significativement plus élevé chez ceux dont le taux sérique initial de ferritine était ≥1000 µg/L que chez ceux dont le taux sérique initial de ferritine était <300 µg/L (HR 3,93 [1,98-7,78], p<0,0001). La dépendance transfusionnelle est un marqueur de la sévérité de la maladie, mais c’est aussi un facteur pronostique indépendant de survie, tout comme la ferritine sérique pourrait être un facteur pronostique indépendant chez les patients ayant besoin de transfusions, confirme le Pr de Witte. À ce jour, seulement 55 patients du registre reçoivent un traitement chélateur du fer.
Effet de la chélation du fer sur la survie
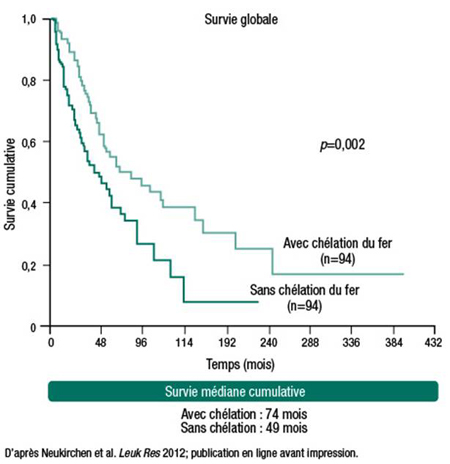
De nombreuses études montrent que la surcharge en fer – définie par un taux sérique élevé de ferritine – abrège la survie des patients atteints d’un SMD. De plus en plus de données montrent également que la chélation du fer pourrait prolonger la survie chez les patients atteints d’un SMD avec dépendance transfusionnelle. Au congrès, la Dre Judith Neukirchen, Heinrich-Heine-Universität, Düsseldorf, Allemagne, et ses collègues ont présenté de nouvelles données sur l’impact des transfusions et de la chélation du fer qui provenaient du registre allemand de Düsseldorf, la plus vaste base de données européenne sur les SMD. L’analyse rétrospective a porté sur 417 patients chez qui on avait mesuré le taux sérique de ferritine. On considérait que les patients avec dépendance transfusionnelle (n=374) étaient chélatés si le traitement chélateur durait depuis au moins 6 mois : 85 patients répondaient à ce critère. La médiane de survie était de 67 mois dans le groupe chélaté vs 30 mois dans le groupe non chélaté (HR et valeurs de p non rapportés). Une analyse de paires appariées du registre de Düsseldorf – sous presse – porte sur 94 patients chélatés et 94 patients non chélatés. Là encore, la survie est plus longue chez les patients chélatés (survie médiane cumulative de 74 mois vs 49 mois chez les patients appariés non chélatés, p=0,002) (Figure 2).
Figure 2. Registre de Düsseldorf : Prolongation de la survie chez les patients atteints d'un SMD chélatés
«La question de savoir si le traitement chélateur du fer n’est qu’une composante du traitement symptomatique ou s’il modifie l’évolution naturelle de la maladie d’une façon quelconque suscite beaucoup d’intérêt à l’heure actuelle, mais nous ne pourrons pas trancher sans données prospectives», affirme la Pre Valeria Santini, Università degli studi di Firenze, Italie. L’étude TELESTO – étude comparative menée à double insu avec placebo et randomisation sur la chélation du fer par le déférasirox chez 630 patients atteints d’un SMD à faible risque – nous apportera des éléments de réponse. Les patients sont randomisés de façon à recevoir le traitement actif ou un placebo selon un ratio 2:1, et le suivi sera de 5 ans. Les critères d’inclusion sont un taux sérique de ferritine >1000 µg/L et des antécédents transfusionnels de 15 à 75 culots globulaires. Le paramètre principal est la survie sans événement (décès, événements cardiaques et hépatiques non mortels).
Dans l’attente des résultats de TELESTO, doit-on offrir la chélation du fer à ces patients? La Pre Santini répond que dans la pratique, sa décision dépend du fardeau de comorbidité, mais en général, elle offre le traitement chélateur. Dans le cadre de l’étude, les patients du groupe placebo peuvent être chélatés si des signes de toxicité du fer apparaissent, souligne-t-elle.
Résultats d’études
«Le gain de survie associé à la chélation du fer pourrait tenir en partie à un meilleur fonctionnement de la moelle osseuse», affirme le Pr Norbert Gattermann, Heinrich-Heine-Universität. «Il pourrait y avoir un cycle vicieux selon lequel la surcharge en fer nuit au fonctionnement de la moelle osseuse, ce qui accroît la dépendance transfusionnelle et la surcharge en fer.»
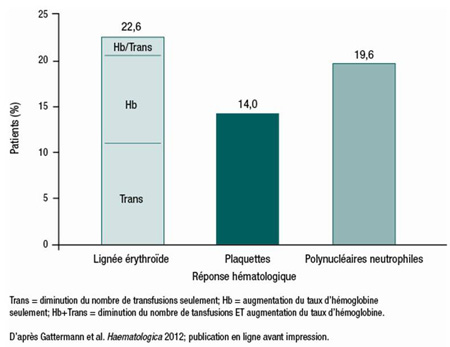
Un nombre croissant de données montrent que la chélation du fer peut améliorer les paramètres hématologiques dans un sous-groupe de patients atteints d’un SMD, poursuit le Pr Gattermann. Il s’agit principalement de réponses érythroïdes, mais on observe aussi des réponses au niveau des plaquettes et des polynucléaires neutrophiles. De nombreux cas cliniques et de petites séries présentées dans la littérature sont maintenant étayés par les résultats des essais EPIC et US03. Une analyse post-hoc de l’essai EPIC – le plus vaste essai à suivre l’efficacité du déférasirox pour réduire la surcharge en fer qui accompagne diverses hémopathies – a montré qu’environ 20 % des patients avaient obtenu une réponse érythroïde (Figure 3). Les chercheurs ont observé une tendance vers une réduction plus marquée du taux sérique de ferritine chez les répondeurs, mais la différence n’a pas atteint le seuil de significativité statistique. L’essai US03 a aussi fait état récemment de réponses hématopoïétiques encourageantes avec le déférasirox : on a observé une réponse des érythrocytes et des polynucléaires neutrophiles chez 15 % des patients, et une réponse des plaquettes, chez 22 % des patients. Improta et ses collaborateurs ont rapporté au congrès que dans une série de 55 patients atteints d’un SMD avec surcharge en fer qui avaient reçu du déférasirox, environ le tiers avaient des besoins transfusionnels moindres après 2 ans de traitement (résumé 0350).
Figure 3. EPIC : Réponses hématologiques chez les patients sous déférasirox
On a proposé plusieurs mécanismes hypothétiques pour expliquer cet effet, mais la théorie la plus séduisante est une diminution du stress oxydatif lié à la charge en fer. Un excédent de stress oxydatif a été étayé dans les SMD, mais il est difficile de savoir quelle proportion de cet excédent est imputable à une surcharge en fer. Des données publiées par Ghoti et al. (Haematologica 2010;95[8]:1433-4) ont fait ressortir des réductions d’un vaste éventail de paramètres d’évaluation du stress oxydatif dans les érythrocytes après 3 mois de traitement par le déférasirox.
De nouvelles connaissances sur la physiopathologie de la surcharge en fer
«Nous continuons d’apprendre sur la physiopathologie de la surcharge en fer associée aux SMD, reconnaît le Pr de Witte. Par exemple, nous savons maintenant que chaque transfusion est suivie d’une augmentation du taux de NTBI.» Ce phénomène s’explique par la transfusion d’érythrocytes âgés, le tiers d’entre eux étant dégradés au cours de la semaine suivant la transfusion, ce qui entraîne un pic de NTBI.
La CHF est peu utilisée comme baromètre de la surcharge en fer chez les patients atteints d’un SMD en raison des risques inhérents à la biopsie du foie. Cela dit, l’IRM étant de plus en plus accessible, la CHF est devenue un moyen pratique de mesurer la surcharge en fer dans les SMD.
Le Pr Gattermann a présenté une analyse groupée de quatre essais sur le déférasirox dans lesquels on avait mesuré la CHF. Les 124 sujets étaient atteints d’un SMD avec surcharge en fer, et la majorité d’entre eux présentaient une CHF extrêmement élevée; en effet, 56 % avaient une CHF >15 mg/g poids sec, ce qui montre que la surcharge en fer est un problème cliniquement pertinent dans les SMD. Le taux d’ALT était aussi élevé chez ces patients, ce qui témoigne d’une dysfonction hépatique. Le traitement par le déférasirox pendant 1 an a eu pour effet d’abaisser à la fois la CHF et le taux sérique de ferritine, de même que le taux d’ALT, ce qui pourrait dénoter une amélioration de la fonction hépatique. Les chercheurs ont de plus observé une corrélation significative entre le taux sérique de ferritine, la CHF et le taux d’ALT.
L’évolution constante des connaissances scientifiques de même que les données à venir prochainement de l’étude TELESTO et du registre de l’UE sur les SMD devraient nous aider à optimiser la prise en charge de la surcharge en fer en présence d’un SMD.