Comptes rendus
Le complément et les manifestations rénales et extrarénales du SHUa : physiopathologie et résultats du traitement
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PRESSE PRIORITAIRE - Semaine du rein 2023 : Assemblée annuelle de l’American Society of Nephrology
Philadelphie, Pennsylvanie / 2 au 5 novembre 2023
Philadelphie – Le syndrome hémolytique et urémique atypique (SHUa) est une forme de microangiopathie thrombotique (MAT) : une dysrégulation de la cascade du complément mène à des thrombi microvasculaires, à une anémie hémolytique microangiopathique, à une thrombopénie et à une atteinte des reins et/ou d’autres organes cibles. Bien que cette maladie soit rare, plusieurs communications et affiches du congrès ont objectivé de nouvelles conclusions sur la prise en charge du SHUa et permis de voir que l’on pourrait un jour aspirer à des soins davantage personnalisés et intégrés grâce à une compréhension toujours meilleure de la régulation/dysrégulation du complément, et de l’éventuel rôle du complément dans une constellation de maladies et d’atteintes associées.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
Cliniquement, le SHU atypique, médié par le complément, touche surtout le rein. On le dit « atypique » pour le distinguer de la forme plus courante du SHU, généralement secondaire à une infection à Escherichia coli producteur de shigatoxines (SHU-STEC). Dans le SHUa, les patients ayant une prédisposition héréditaire ou acquise à la dysrégulation du complément finissent par présenter une MAT manifeste, souvent après un événement déclencheur altérant l’endothélium vasculaire.
Bien que le SHUa ait toujours été considéré comme une maladie rare touchant surtout le rein, de nouvelles données présentées au congrès pourraient élargir notre vision de l’incidence du SHUa et de sa relation avec les symptômes médiés par le complément dans d’autres systèmes organiques. La Dre Sara Boynton, Johns Hopkins Children’s Center, Baltimore, et al. ont exploré l’incidence du SHUa chez plus de 20 000 enfants atteints d’une maladie rénale chronique ou terminale dans le registre NAPRTCS (North American Pediatric Renal Trials and Collaborative Studies). Ils ont repéré un sous-groupe de candidats à la greffe qui n’avaient pas reçu de diagnostic de SHUa, mais dont la pathologie rénale était d’étiologie inconnue ou liée à une atteinte associée aux MAT. Parmi les 95 patients inclus dans l’analyse, environ le tiers étaient porteurs d’un ou de plusieurs marqueurs de MAT clinique, alors que 42 % présentaient à la fois une thrombopénie et une hémolyse microangiopathique en plus de leurs symptômes rénaux. Les manifestations extrarénales de MAT étaient aussi fréquentes : 31 % des patients présentaient une hypertension, 19 %, des symptômes digestifs et 44 %, un retard de croissance ou un poids insuffisant. « Cette analyse montre que la prévalence du SHUa dans le registre NAPRTCS pourrait être plus élevée qu’on croyait1 », concluent-ils.
Pour comprendre les implications de ces données et d’autres données du congrès pour les cliniciens du Canada, Réseau d’éducation médicale a interviewé le Dr Christoph Licht, SickKids Hospital, Toronto, expert international en maladies rénales médiées par le complément et l’un des principaux collaborateurs du registre mondial sur le SHUa. « Les manifestations extrarénales [du SHUa] montrent que la portée pathologique du complément va bien au-delà du rein, affirme le Dr Licht. Nous devons aborder les manifestations inexpliquées en gardant cela à l’esprit. Et il nous faut penser traitement : nous avons maintenant des médicaments ciblés qui nous permettent d’intervenir là où nous n’avions rien à offrir auparavant. »
Aux yeux du Dr Licht, la présentation du Dr Richard Coward, University of Bristol, Angleterre, et al. a été la plus fascinante. Ses questions ont forcé l’auditoire à réfléchir au rôle potentiel du complément dans des maladies récurrentes du rein et d’autres organes. « Pour moi, cette présentation a été la plus marquante : les auteurs ont osé parler de ce qu’on commence à explorer et qui a juste effleuré l’esprit d’autres chercheurs. C’était la première fois qu’on en parlait officiellement. Se pourrait-il qu’on sous-estime complètement l’importance et le nombre de maladies médiées par le complément qui aboutissent à des pathologies désignées autrement et que le cœur du problème soit le complément? »2
Regard sur les résultats du traitement par un inhibiteur du C5 en conditions réelles
L’éculizumab et le ravulizumab, inhibiteurs de la composante C5 (iC5) de la voie terminale du complément administrés par voie i.v., sont indiqués au Canada pour la prise en charge du SHUa chez l’adulte et l’enfant de 1 mois ou plus. Administré toutes les 2 semaines, l’éculizumab – premier iC5 commercialisé – est devenu le traitement de référence. Le ravulizumab, produit de deuxième génération dérivé de l'éculizumab et administré toutes les 8 semaines, a été commercialisé dans de nombreux pays au cours des dernières années. Plusieurs affiches du congrès portant sur des recherches en conditions réelles ont décrit en quoi la présence de deux options de traitement avait modifié les résultats cliniques et les résultats rapportés par les patients.
Le Dr Franz Schaefer, Hôpital universitaire de Heidelberg, Allemagne, et al. ont décrit les caractéristiques et les résultats cliniques de 43 adultes et 17 enfants du registre mondial du SHUa (collaboration multinationale permettant de recueillir des données en conditions réelles depuis 2012) qui étaient passés de l’éculizumab au ravulizumab. Environ le tiers des patients étaient des greffés rénaux, et les manifestations extra-rénales étaient fréquentes : 48 % dans l’appareil digestif et 32 % dans le système nerveux central. Globalement, le débit de filtration glomérulaire estimé (DFGe), la numération plaquettaire et le taux de lactodéshydrogénase (LDH) sont restés stables après le passage au ravulizumab; aucun nouvel événement (dialyse, greffe rénale ou MAT récidivante) n’a été rapporté. « Ces résultats étayent l'efficacité réelle du ravulizumab dans le SHUa après un traitement par l’éculizumab3 », concluent les auteurs.
Yan Wang et al., Centre Alexion-AstraZeneca - Maladies rares, ont présenté deux affiches où ils avaient eu recours au programme Adelphi spécifique du SHUa (base de données d’un tiers intégrant les données réelles disponibles) pour évaluer les résultats cliniques et les résultats subjectifs des patients ayant reçu du ravulizumab de novo ou après l’éculizumab. Les marqueurs cliniques clés du SHUa (créatininémie, LDH et plaquettes) se sont globalement améliorés sous ravulizumab vs sous éculizumab; le ravulizumab a aussi été efficace pour améliorer ces paramètres par rapport aux valeurs initiales chez les patients jamais traités (Figure 1). Ces améliorations cliniques ont donné lieu à des gains de qualité de vie, les santés physique et mentale ayant souvent été cotées de « bonnes » à « excellentes »4.
Figure 1. Résultats cliniques d’un traitement par le ravulizumab de novo ou après l’éculizumab
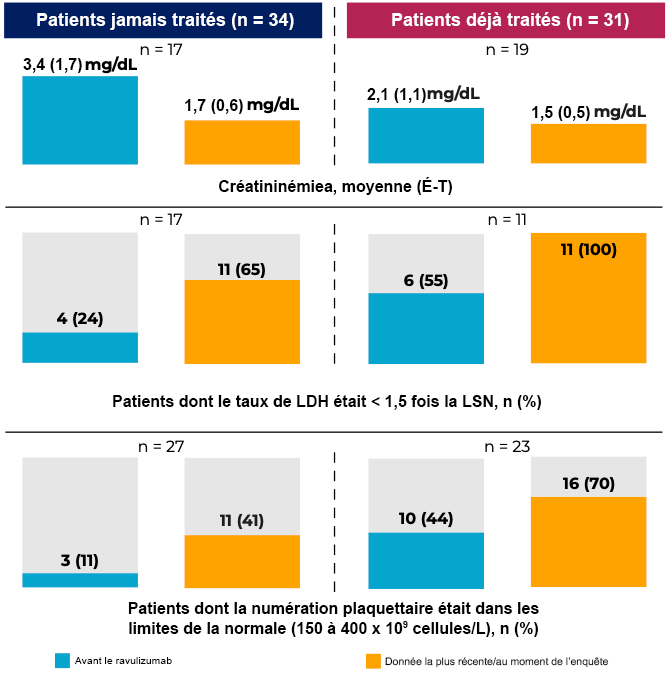
« Donnée la plus récente/au moment de l’enquête » fait référence au moment où les médecins extraient les données chez chacun de leurs patients.
aCréatinémie normale : 0,7 à 1,3 mg/dL chez l’homme et 0,6 à 1,1 mg/dL chez la femme
É-T, écart type; LDH, lactodéshydrogénase; LSN, limite supérieure de la normale.
D’après Wang Y et al. Affiche SA-PPO920, Semaine du rein 20233
Reposant sur les mêmes données d’Adelphi, la deuxième affiche portait sur la satisfaction des patients et des médecins à l’égard du ravulizumab. La satisfaction générale des médecins était élevée pour tous les patients (jamais ou déjà traités); aucun médecin n’était insatisfait. La satisfaction des patients était aussi élevée : 86 % étaient plus satisfaits du ravulizumab que de l’éculizumab, et 14 % ont attribué la même cote aux deux agents. Parmi les médecins, 92 % ont cité le nombre moindre de perfusions comme un motif clé de changement de traitement; 52 % ont mentionné un fardeau moindre pour les patients et les soignants, et 32 % ont noté une efficacité améliorée. « Il y avait concordance entre les médecins et les deux cohortes de patients quant à la satisfaction; aucune insatisfaction à l’égard du ravulizumab n’a été rapportée5 », concluent les auteurs.
Interrogé sur les facteurs les plus importants à considérer pour les cliniciens du Canada traitant un SHUa par l’éculizumab ou le ravulizumab, le Dr Licht a évoqué la durée appropriée du traitement, la façon de gérer l'arrêt du traitement et le risque de récidive. « Nous comprenons bien le profil de risque clinique [dans le SHUa], et cela nous aide à déterminer la durée du traitement dans la majorité des cas. Seuls les cas exceptionnels devront probablement être traités à long terme, explique-t-il. Dans la plupart des cas, le traitement durera entre 3 et 6 mois, puis sera arrêté; la maladie sera considérée comme épisodique et potentiellement récidivante, le traitement devant être répété lors d’une récidive. »
Vers une plus grande personnalisation du traitement
Comme pour bien d’autres maladies, notre compréhension grandissante de la physiopathologie et des biomarqueurs du SHUa pourrait bientôt paver la voie à une « médecine de précision » car nous pourrons repérer les patients à haut risque ou ceux susceptibles de répondre au traitement.
Selon plusieurs communications, un déficit en facteur H du complément (CFH) est probablement un facteur de risque important de SHUa. Le CFH est un régulateur clé de la voie alterne du complément et contribue étroitement à protéger l’organisme contre des lésions médiées par le complément. Schaefer et al.ont étudié le registre mondial du SHUa et constaté que la mutation du gène codant pour le CFH était à l’origine du variant pathogène le plus courant présent chez environ le tiers des adultes et le quart des enfants3. Deux autres études de cas ont étayé le déficit en CFH comme étant un facteur contributif dans le SHUa :
- Dans un cas de MAT post-greffe rénale, les chercheurs ont repéré une mutation du CFH qui, en présence de nombreux facteurs déclenchants, a compliqué la prise en charge de la MAT. Au bout du compte, le patient a bien répondu à l’éculizumab et au bélatacept; la mutation du CFH serait donc « une bonne indication de la nécessité de poursuivre l’utilisation de l’éculizumab6».
- Une MAT post-partum a d’abord été considérée comme un purpura thrombopénique thrombotique (PTT); la détection d’un faible taux de CFH a mené au diagnostic de SHUa, et le traitement par l’éculizumab a été efficace7.
Interrogé sur le potentiel de la médecine personnalisée dans le SHUa et le rôle du registre mondial à cet égard, le Dr Licht a déclaré : « Les grands efforts que les collaborateurs [au registre] déploient sans relâche pour relier les résultats et le génotype, y compris les mutations et la présence d’anticorps, auront un impact sur le tableau d’ensemble. Je prédis que, pour la plupart des questions que nous avons abordées, il y aura une sorte de réanalyse des données et nous pourrons nous prononcer sur les corrélations génotype-phénotype. C’est très important à mon avis, car nous pourrons alors faire des prédictions plus fiables, et [analyser] le résultat escompté chez les patients [ayant un génotype spécifique]. »
Références
1. Boynton SA, et al. Affiche FR-PO652, Semaine du rein 2023, 2 au 5 novembre 2023.
2. Coward R et al. Séance de médecine translationnelle : Complement as a target in CKD. Communication orale, Semaine du rein 2023, 2 au 5 novembre 2023.
3. Schaefer F et al. Affiche SA-PO922, Semaine du rein 2023, 2 au 5 novembre 2023.
4. Wang Y et al. Affiche SA-PO920, Semaine du rein 2023, 2 au 5 novembre 2023.
5. Wang Y et al. Affiche SA-PO921, Semaine du rein 2023, 2 au 5 novembre 2023.
6. Capistrano MC et al. Affiche FR-PO760, Semaine du rein 2023, 2 au 5 novembre 2023.
7. Ho T et al. Affiche TH-PO817, Semaine du rein 2023, 2 au 5 novembre 2023.