Comptes rendus
L’hématologie à l’ère de la COVID-19 : Mise à jour sur l’hémoglobinurie paroxystique nocturne (HPN)
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PRESSE PRIORITAIRE - EHA2021 virtuel – European Hematology Association (EHA)
En ligne / 9–17 juin 2021
En ligne – Les nouvelles réalités médicales de la pandémie de COVID-19 en hématologie – dont l’impact sur la prise de décisions cliniques dans les hémopathies prothrombotiques comme l’HPN – ont été au cœur du congrès EHA2021 virtuel de 5 jours. Quoique rare, cette maladie a généré beaucoup de données et de commentaires en raison de rapides progrès scientifiques. Outre la vaccination contre la COVID-19 en présence d’HPN, il a été question de nouveaux agents qui s’ajouteront à l’éculizumab – le traitement de référence – dans la pratique clinique. Près de 20 résumés et affiches électroniques sur l’HPN et 12 communications scientifiques formelles ont porté sur le pegcétacoplan, le ravulizumab et l’iptacopan (traitement oral, premier de sa classe).
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
Citant le Pr Lucio Luzzatto, un pionnier, le Dr Austin Kulasekararaj a qualifié l’HPN du « plus virulent état thrombophile acquis en médecine ». Rare, chronique et potentiellement mortelle, cette maladie se caractérise par une activation incontrôlée de la voie terminale du complément, d’où une hémolyse intravasculaire, des thromboses et une atteinte des organes cibles. Le Dr Kulasekararaj dirige le centre de l’HPN du King’s College Hospital, l’un des deux grands centres d’HPN au Royaume-Uni.
Avant l’avènement de l’éculizumab, inhibiteur de C5, 35 % des patients, la plupart jeunes trentenaires, mouraient dans les 5 ans suivant le diagnostic malgré des soins de soutien optimaux, a rappelé le Dr Kulasekararaj. Le pronostic s’est amélioré, certes, mais le diagnostic demeure difficile.
« C’est dans la tête » : les difficultés du diagnostic de l’HPN
Le diagnostic de l’HPN peut prendre 10 ans ou plus, en supposant que le patient survive aussi longtemps, poursuit le Dr Kulasekararaj, qui a parlé du cas d’une femme de 39 ans présentant une prétendue hématurie, une fatigue chronique et un taux d’hémoglobine « très convenable » de 110–120 g/l. « Lorsque je l’ai vue, elle prenait déjà quelques antidépresseurs, et tous croyaient que ses maux [étaient] psychologiques », explique-t-il. Trois ans après les premiers signes, une hémoglobinurie, une dysphagie et des douleurs abdominales sont apparues, et les tests ont révélé un clone HPN érythrocytaire d’une taille de 49,2 %.
Le Dr Wolfgang Füreder, École de médecine de l’Université de Vienne, a mis l’auditoire en garde : « Dans l’HPN, le bilan sanguin peut être parfaitement normal, ne l’oublions pas ». Une participante, Hadeel Ammar, a demandé s’il fallait être à l’affût d’une HPN chez tous les patients présentant un taux d’hémoglobine normal et une thrombose spontanée à un endroit inhabituel ». Un taux élevé de lactate déshydrogénase (LDH) devrait vous alerter, a répondu le Dr Füreder.
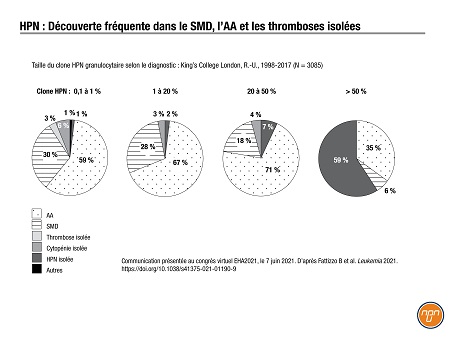
Le diagnostic d’une HPN est particulièrement difficile dans d’autres contextes hématologiques. Le Dr Kulasekararaj a résumé 19 ans de données du King’s College London1 montrant que la plupart des patients ayant un clone HPN ≤ 50 % avaient reçu un diagnostic de syndrome myélodysplasique (SMD), d’anémie aplasique (AA) ou de thrombose isolée (N = 3085; voir la Figure 1).
Figure 1.
COVID-19 et autres infections
Les conférenciers ont discuté de leur expérience avec la vaccination anti-COVID-19 chez les patients atteints d’HPN. Le Dr Robert Brodsky, directeur de la division d’hématologie, Johns Hopkins University, a expliqué qu’entre le tiers et la moitié de ses patients avaient eu une poussée d’hémolyse nécessitant une transfusion après que le vaccin ait entraîné une activation du complément.
Les patients et les médecins doivent savoir que de telles réactions « ne sont pas inhabituelles » et qu’elles se résorbent en quelques jours. « Le ratio risque:bénéfice [du vaccin] est favorable au patient », conclut le Dr Brodsky.
Bien qu’il n’y ait pas encore de données sur la COVID-19 dans l’HPN, les anomalies associées au complément dans l’HPN sont connues pour prédisposer les patients aux infections, bactériennes en général. Dans une affiche, la Dre Bhumika Patel, Taussig Cancer Institute, Cleveland Clinic, a tenté de quantifier l’ampleur du risque. Patel et al. ont comparé le taux d’incidence des infections graves nécessitant une hospitalisation chez 1083 patients atteints d’HPN et 3249 témoins à l’aide de la base de données commerciale IBM MarketScan2. Les infections graves, bactériennes pour la plupart, étaient 8 fois plus probables en présence d’HPN (incidence/100 années-personnes : 12,7 vs 1,7 [HPN vs témoins, respectivement]).
La Dre Louise Arnold, centre d’HPN de Leeds, au R.-U., a présenté « la plus vaste expérience » sur la prise en charge efficace du risque d’infection à Neisseria meningitidis chez des patients atteints d’HPN recevant un inhibiteur du complément3. Entre 2002 et 2020, 324 patients du R.-U. ont reçu 801 vaccins MenACWY; à partir de 2015, 287 patients ont aussi reçu Bexsero (vaccin contre le MenB). Sur une période de 18 ans, le centre a eu 9 cas d’infection invasive à méningocoque, dont un cas mortel, probablement en raison d’une consultation tardive. « Les patients doivent être à l’affût d’une fièvre et consulter un médecin sans délai en précisant qu’ils souffrent d’HPN et reçoivent un inhibiteur du complément », concluent les auteurs.
Nouvelles options de traitement
Les conférenciers ont fait état de la « perspective fort intéressante » de nouveaux traitements pour l’HPN.
Au traitement de référence actuel, l’éculizumab, inhibiteur de C5, vient de s’ajouter un dérivé, le ravulizumab, dans l’Union européenne et aux États-Unis. (Le ravilizumab n’est pas commercialisé au Canada pour l’instant.) Le ravulizumab se caractérise par une demi-vie plus longue et, par conséquent, une administration moins fréquente que l’éculizumab. Le Dr Srikanth Nagalla, Miami Cancer Institute, a présenté au congrès des données tirées de la pratique sur l’éculizumab et les premières données sur le ravulizumab (N = 1330)4. Dans une entrevue par courriel, le Dr Nagalla a émis une réserve quant au petit échantillon de patients sous ravulizumab; cela dit, ses collègues et lui ont noté des « tendances similaires [...] dans les groupes de traitement ».
Au nombre des inhibiteurs de la voie proximale du complément présentés au congrès figurait le pegcétacoplan, administré par perfusion s.-c. dans l’abdomen tous les 3 jours. Selon les affiches des Drs Régis Peffault de Latour, Université de Paris, et Alexander Röth, Université de Duisbourg et Essen, sur la prolongation de 48 semaines de l’essai pivot PEGASUS, 73 % des patients sous pegcétacoplan n’avaient toujours pas reçu de transfusion à 48 semaines5, sans compter que les taux de fatigue et de dyspnée s’apparentaient à ceux d’une population normale6. L’essai a été mené chez des non-répondeurs à l’éculizumab.
Dans PEGASUS, à 16 semaines, le pegcétacoplan avait amélioré significativement le taux moyen d’hémoglobine par rapport à l’éculizumab (peg, n = 41; écu, n = 39)5; 85 % des patients sous pegcétacoplan ont évité une transfusion vs 15 % des patients sous éculizumab. Dans un tour d’horizon des nouveaux traitements, le Dr Brodsky a précisé que ces résultats n’étaient pas inattendus compte tenu de la dépendance transfusionnelle initiale chez 80 % des patients sous éculizumab.
Dans PEGASUS, les effets indésirables (EI) les plus fréquents étaient les réactions au point d’injection (36 %), l’hémolyse (24 %) et la diarrhée (21 %); 30 % ont eu des EI graves et dans 6 % des cas, un lien avec le médicament a été jugé possible5. Le Dr Brodsky – qui présentait des données sur l’hémolyse aiguë avec les deux médicaments – a fait remarquer que seuls les patients sous pegcétacoplan avaient un taux élevé de LDH. Cette élévation est préoccupante à cause de l’éventuel risque accru de thrombose », ajoute le Dr Brodsky. « Nous devons faire la lumière là-dessus. »
Le premier traitement oral contre l’HPN dont on a parlé au congrès est l’iptacopan (LNP023), inhibiteur du facteur B. Le Dr Jun Ho Jang, Université Sungkyunkwan, Séoul, a présenté les résultats d’une étude de phase II sur la détermination de la dose d’iptacopan chez des patients jamais exposés à un inhibiteur de C5. Des doses d’iptacopan pouvant atteindre 200 mg ont abaissé le taux de LDH d’au moins 60 % chez tous les patients (N = 13)7. À une exception près, tous les patients n’avaient toujours pas reçu de transfusion à 12 semaines. Aucun EI grave n’a été signalé. Le Dr Kulasekararaj, président de la séance, a dit craindre un risque accru d’infections associé aux inhibiteurs de la voie proximale du complément. Le Dr Ho Jang a rétorqué qu’il n’y avait aucune preuve de cela et que « nous avons besoin d’autres données ». (Le pegcétacoplan n’est pas homologué au Canada.)
Conclusions
L’HPN est une maladie rare, évolutive et potentiellement mortelle dont le diagnostic est souvent rendu difficile par la présence d’autres hémopathies. Les délégués ont été fortement encouragés à mesurer le taux de LDH en présence d’anémie et de thromboses inexpliquées. Le vaccin contre la COVID-19 est associé à un ratio risque:bénéfice favorable, mais les médecins doivent être conscients du risque d’hémolyse aiguë transitoire. La moindre fièvre doit inciter les patients atteints d’HPN à consulter un médecin sur-le-champ et à signaler leur maladie au personnel des urgences. Les inhibiteurs de C3 et du facteur B dans la voie proximale du complément sont au nombre des nouveaux traitements.
Références :
1. Fattizzo B et al. Clinical and prognostic significance of small paroxysmal nocturnal hemoglobinuria clones in myelodysplastic syndrome and aplastic anemia. Leukemia. Publié en ligne le 4 mars 2021. https://doi.org/10.1038/s41375-021-01190-9
2. Patel BJ et al. Risk of serious infections in patients with or without paroxysmal nocturnal hemoglobinuria: A real-world matched cohort analysis. EHA2021 en virtuel, du 9 au 17 juin 2021. Affiche EP596.
3. Arnold , et al. Management of meningococcal disease risk in patients with paroxysmal nocturnal hemoglobinuria (PNH) on complement inhibitors: 18 years’ experience from the UK National PNH Service in Leeds. EHA2021 en virtuel, du 9 au 17 juin 2021. Affiche EP592.
4. Nagalla S et al. Ravulizumab and eculizumab reduce transfusions in adult patients with paroxysmal nocturnal hemoglobinuria: Evidence from three real-world databases: TriNetX U.S. EMR, TriNetX U.S. Claims and KOMODO Health. EHA2021 en virtuel, du 9 au 17 juin 2021. Affiche EP1337.
5. Peffault de Latour R et al. Forty-eight week efficacy and safety of pegcetacoplan in adult patients with paroxysmal nocturnal hemoglobinuria and suboptimal response to prior eculizumab treatment. EHA2021 en virtuel, du 9 au 17 juin 2021. Affiche S174.
6. Röth A et al. Effect of pegcetacoplan on quality of life in patients with paroxysmal nocturnal hemoglobinuria: week 48 of PEGASUS phase 3 trial comparing pegcetacoplan to eculizumab. EHA2021 en virtuel, du 9 au 17 juin, 2021. Affiche EP595.
7. Ho Jang J et al. First-line treatment of PNH patients with iptacopan leads to rapid and durable hemoglobin increase by controlling both intra- and extravascular hemolysis. EHA2021 en virtuel, du 9 au 17 juin 2021. Affiche S173.