Comptes rendus
Une maladie rénale rare à l’ère de la COVID-19 : Mise à jour sur le syndrome hémolytique et urémique atypique (SHUa)
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PRESSE PRIORITAIRE - Semaine du rein de 2021 (American Society of Nephrology)
En ligne / 4-7 novembre 2021
En ligne – Bien que rare, le syndrome hémolytique et urémique atypique (SHUa) a été au cœur de la Semaine du rein. Il a été question du 2e cas de SHUa causé par la COVID-19. Les présentateurs ont exploré les difficultés associées au diagnostic d’un SHUa, maladie principalement caractérisée par une atteinte rénale, en se penchant sur des réussites thérapeutiques et des données sur les biomarqueurs. Il a aussi été question de l’optimisation du traitement de référence au Canada, l’éculizumab, et d’essais sur de nouveaux traitements.
Rédactrice médicale en chef : Dre Léna Coïc, Montréal, Québec
« [J’ai été] étonné de voir que la COVID-19 affecte autant les reins », a affirmé le Dr Rahul Abraham, LSU Health Shreveport, Louisiane, lors d’une interview durant la Semaine du rein, le congrès phare de l’American Society of Nephrology.
Le Dr Abraham a présenté une communication1 sur une manifestation inhabituelle de la COVID-19 : le SHUa. Ce n’est que le 2e cas signalé à l’échelle planétaire. Le SHUa, forme rare de microangiopathie thrombotique (MAT), découle d’un défaut de régulation et d’une activation excessive de la voie alterne du complément, d’où la triade anémie hémolytique avec Coombs négatif + thrombopénie + insuffisance rénale aiguë. Associé à un taux de mortalité de 25 %, le SHUa évolue vers une maladie rénale terminale chez la moitié des patients1. Santé Canada a homologué le 1er traitement pour le SHUa en mars 2013 : l’éculizumab, inhibiteur du C5.
Malgré sa rareté, le SHUa a fait couler de l’encre durant la Semaine du rein : 3 séances et 22 affiches reflètent le vif intérêt des médecins pour le diagnostic et les nouveaux traitements. « Les reins semblent être la cible première du SHUa », a expliqué un porte-parole de l’industrie après la présentation d’une affiche sur le ravulizumab, inhibiteur du C5 (non homologué au Canada pour le SHUa).
Difficultés du diagnostic d’un SHUa : biomarqueurs
Onze des 22 affiches ont porté sur les difficultés du diagnostic d’un SHUa. « De toute évidence, nous avons besoin de meilleurs biomarqueurs pour cette maladie », a déclaré la Dre Caroline Duineveld, Centre médical de l’université Radboud, Pays-Bas, ajoutant que son centre avait des difficultés à repérer un SHUa assez rapidement après une greffe du rein2.
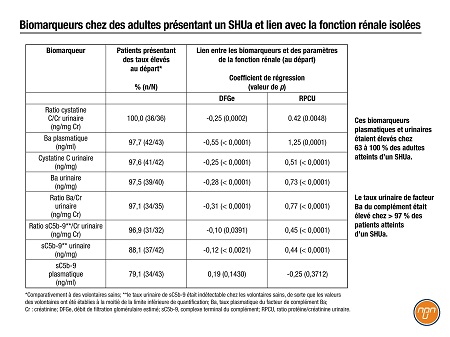
Des biomarqueurs commencent à émerger des analyses secondaires d’essais pivots sur de nouveaux médicaments. Une équipe de l’industrie a présenté une analyse exploratoire3 des biomarqueurs du diagnostic et du pronostic d’un SHUa dans le cadre d’une étude de phase III sur le ravulizumab. Les taux de 8 biomarqueurs urinaires et plasmatiques étaient élevés chez 63 à 100 % des adultes présentant un SHUa (Tableau 1); les taux urinaires de facteur du complément Ba étaient plus élevés chez tous les patients, sauf un (N = 32), et il y avait un lien significatif avec les améliorations cliniques post-traitement (données non illustrées).
Tableau 1. Biomarqueurs chez des adultes présentant un SHUa et lien avec la fonction rénale1
Difficultés du diagnostic d’un SHUa : cas cliniques
Les Drs Abraham, Nicole Wyatt (Brookwood Baptist Health, Birmingham, Alabama) et Fehlin Stone (Walter Reed National Military Medical Center, Bethesda, Maryland) ont discuté de leur processus décisionnel et des éléments d’information qui leur avaient permis de diagnostiquer un SHUa chez leurs patients.
Cas 1 – Dr Abraham : femme de 55 ans souffrant d’une atteinte rénale aiguë (ARA) consécutive à la COVID-191
État mental altéré; dyspnée; créatinine (Cr) 4,8 mg/dL; Hb 8,9 g/dL; plaquettes 20 000/µL; frottis : nombre élevé de schizocytes et thrombopénie; haptoglobine 28 mg/dL; réticulocytes: 3,8 %; score PLASMIC : 6; aucune amélioration significative sous l’effet des échanges plasmatiques et des stéroïdes; taux d’ADAMTS13 : 65 %, excluant ainsi un diagnostic de purpura thrombotique thrombopénique (PTT). La patiente a répondu « remarquablement bien » (en quelques jours) au traitement par l’éculizumab, mais l’ARA a évolué vers une maladie rénale terminale.
Commentaire du Dr Abraham : « Vu le retour du taux d’ADAMTS13 à l’intérieur de limites acceptables, un [SHUa] est beaucoup plus probable. »
Cas 2 – Dre Wyatt : femme de 20 ans, à 30 semaines d’une 1re grossesse4
Douleur abdominale sévère, saignement vaginal diffus; la césarienne a révélé un décollement placentaire et la mort du fœtus; créatininémie maximale : 8,43 mg/dL; Hb 5,5 g/dL; plaquettes 15 000/µL; lactate déshydrogénase 9051 U/L; schizocytes sur le frottis; aggravation des symptômes malgré le traitement de suppléance rénale, les échanges plasmatiques quotidiens et les stéroïdes; taux d’ADAMTS13 : 83 %. Après 1 semaine de traitement par l’éculizumab, « le bilan sanguin s’est normalisé, et la fonction rénale semblait en voie de rétablissement ». La patiente est demeurée en rémission après 6 mois de traitement par l’éculizumab. Test génétique : variant rare de THBD (gène codant pour la thrombomoduline).
Commentaire de la Dre Wyatt : « Dans notre cas, le diagnostic différentiel se jouait initialement entre le syndrome HELLP et le PTT [...] Le diagnostic de syndrome HELLP a été exclu lorsque l’état clinique de la patiente a continué de se détériorer après l’accouchement. Le taux normal d’ADAMTS13 a finalement permis d’exclure la possibilité d’un PTT. »
Cas 3 – Dr Stone : « Diagnostic épineux » chez un homme de 22 ans présentant une hypertension, une perte de vision et une ARA5
TA : 240/140; œdème papillaire bilatéral de grade IV selon la classification de Frisén; créatininémie : 4,9 mg/dL; protéinurie : 4 g; numération plaquettaire, Hb, LDH, haptoglobine, autoanticorps du facteur H, complément, hépatite/VIH, biomarqueurs de maladies auto-immunes, cryoglobulines : tous normaux; biopsie rénale : > 50 % d’obsolescence glomérulaire et 35 % de fibrose interstitielle/atrophie tubulaire et indicateurs artériolaires « inquiétants pour une MAT subtile ». Génétique : délétion homozygote de CFHR3-CFHR1, ce qui a confirmé une MAT médiée par le complément. La vision, la TA et la créatininémie se sont améliorées sous l’effet des antihypertenseurs et des inhibiteurs de C5.
Commentaire du Dr Stone : « C’est le bilan totalement négatif ou presque qui m’a le plus étonné. La quasi-totalité des examens de laboratoire étaient normaux. La biopsie pouvait orienter vers une MAT, mais nous n’avions aucune idée du type […] La requête d’un dosage du facteur H et de tests génétiques ne visait qu’à différencier les diagnostics possibles. »
Quel conseil ces médecins donneraient-ils à leurs confrères et consœurs?
Selon le Dr Stone : « [Ne vous] énervez pas, et évaluez les diagnostics différentiels en toute logique. Pour ce patient, malheureusement, tous les diagnostics étaient possibles [...], mais ce fut très gratifiant de finalement avoir une réponse à lui donner et un traitement à lui proposer. »
Selon la Dre Wyatt : « Il est raisonnable d’instaurer un traitement inhibiteur du complément dans l’attente des résultats des autres examens chez une patiente en post-partum qui présente une MTA et une insuffisance rénale. Il est essentiel de demander des tests génétiques dans tous les cas où l’on soupçonne un SHUa associé à une grossesse. »
Utilisation optimale de l’éculizumab
On a aussi présenté au congrès l’étude d’observation néerlandaise CUREiHUS, dont l’objectif est de surveiller la mise en application des recommandations en vigueur aux Pays-Bas selon lesquelles le traitement par l’éculizumab doit être arrêté chez les patients rétablis d’un SHUa6. Dans cette étude CUREiHUS, 21 patients ont été suivis de janvier 2016 à octobre 2020. Après le rétablissement complet des paramètres d’une MAT – et un traitement de 13,6 semaines (extrêmes : 2,1 et 43,9) – le traitement par l’éculizumab a été arrêté. Durant le suivi de 80,7 semaines, une récidive est survenue chez 4 patients (19,0 %); l’intervalle médian précédant la 1re récidive a été de 14,3 semaines (7,1 et 62,0). Les patients en récidive ont été traités de nouveau par l’éculizumab – avec succès, d’ailleurs – après quoi le traitement a de nouveau été arrêté. Aucun prédicteur cliniquement important de la récidive n’a été repéré.
La Dre Romy Bouwmeester, Centre médical de l’université Radboud, a indiqué qu’un suivi centralisé aurait été utile pour la surveillance des patients dans l’étude CUREiHUS : « Nous recommandons à nos confrères et consœurs du Canada d’essayer de centraliser la coordination des soins de tous les patients atteints d’un SHUa [et] de prévoir des visites de suivi fréquentes durant la 1re année suivant l’arrêt du traitement par l’éculizumab, car la majorité des récidives surviennent au cours de la 1re année. »
Traitements futurs, essais canadiens
Les communications par affiche ont aussi fait le point sur des traitements pour le SHUa qui ne sont pas encore homologués au Canada.
Le crovalimab est un inhibiteur de C5 expérimental que les patients s’auto-injectent. Des chercheurs de Roche et d’établissements universitaires d’Europe, d’Asie et des États-Unis ont présenté 2 essais de phase III visant à évaluer le crovalimab chez les enfants (COMMUTE-p; NCT04958265) et chez les adolescents/adultes (COMMUTE-a; NCT04861259)7. Dans l’étude en pédiatrie, on a commencé à recruter des patients au CHU Sainte-Justine de Montréal le 20 novembre dernier; dans l’étude chez les adultes, le recrutement a débuté le 22 octobre dans 68 centres de recherche partout dans le monde, notamment au Vancouver General Hospital, au St. Michael’s Hospital et au Toronto General Hospital.
Des chercheurs de Novartis et d’établissements universitaires partenaires ont présenté leurs plans pour APPELHUS (NCT04889430), étude ouverte de phase III à groupe unique sur l’iptacopan, inhibiteur du facteur B expérimental qui s’administre par voie orale8. Le recrutement – qui a débuté le 8 novembre – vise un effectif de 50 adultes en Autriche, en Grèce et au Japon.
Les scientifiques d’Alexion/AstraZeneca ont présenté une affiche oralement sur le plan d’une étude de phase III randomisée et menée à double insu avec placebo sur le ravulizumab, inhibiteur de C5, chez des adultes aux prises avec une MAT associée à un facteur déclenchant9. L’étude d’envergure mondiale (NCT04743804) a commencé en avril 2021.
Conclusions
L’atteinte rénale est une caractéristique centrale du SHUa, et un diagnostic précoce est essentiel. Bien que le diagnostic du SHUa soit difficile et que ce soit généralement un diagnostic d’exclusion, des biomarqueurs comme le taux urinaire du facteur de complément Ba et les tests génétiques peuvent être utiles. C’est souvent la disparition des symptômes grâce au traitement par l’éculizumab qui confirme le diagnostic. Le ravulizumab, le crovalimab et l’iptacopan sont au nombre des traitements potentiels à venir.
Références :
1. Abraham RR, Akabane H. Affiche PO0125 présentée à la Semaine du rein, 4-7 nov. 2021.
2. Duineveld C et al. Affiche PO1550, ibid.
3. Cammett TJ et al. Affiche PO0239, ibid.
4. Wyatt N et al. Affiche PO2229, ibid.
5. Stone F et al. Affiche PO0293, ibid.
6. Bouwmeester RN et al. Affiche PO1655, ibid.
7. Sheerin NS et al. Affiche INFO07, ibid.
8. Kavanagh DG et al. Affiche INFO30, ibid.
9. Zeesham K et al. Affiche INFO27, ibid.