Comptes rendus
Possibilités de prolongation de la survie dans le cancer colorectal avancé : de plus en plus de données à l’appui du traitement chronique
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PERPECTIVE PROFESSIONNELLES - Point de vue sur la littérature
décembre 2012
Sous la direction de :
Sharlene Gill, MD, MPH, FACP, FRCPC
Gastro-entérologue oncologue
BC Cancer Agency
Professeure agrégée de médecine
University of British Columbia
Vancouver (Colombie-Britannique)
Introduction
Les anticorps monoclonaux (AcM) ont pavé la voie à la maîtrise prolongée du cancer colorectal métastatique (CCRm). Contrairement aux agents cytotoxiques qui ont pour effet direct de réduire le volume de la tumeur, les AcM ciblés peuvent inhiber les événements moléculaires qui régissent la vascularisation et la prolifération tumorales. On continue d’évaluer de nouveaux schémas afin de déterminer s’il est possible de stopper la croissance tumorale à long terme en inhibant ces événements. Un essai de phase III a récemment permis de constater que la poursuite du traitement par un AcM, le bévacizumab, donnait lieu à un gain de survie, même après l’apparition de signes de progression. Les thérapies ciblées étant associées à un fardeau moindre d’effets indésirables, cette prolongation de la survie représente un tournant. De nouvelles données cliniques sur l’aflibercept et le regorafenib – tous deux maintenant homologués pour le traitement du CCRm dans certains pays – témoignent de l’intensification des efforts que l’on déploie pour ajouter des thérapies ciblées à l’arsenal thérapeutique dans le CCR avancé.
Le cancer colorectal métastatique (CCRm) demeure pour l’essentiel une maladie incurable, mais la durée de la maîtrise de la maladie ne cesse d’augmenter depuis le jour où, il y a près de 20 ans, on a démontré que le 5-fluoro-uracile (5-FU) doublait la médiane de survie globale (SG) par rapport aux soins de soutien (11 vs 5 mois; p=0,006)1. D’autres agents chimiothérapeutiques actifs dans le CCRm, comme l’oxaliplatine, l’irinotécan et la capécitabine, ont contribué aux gains successifs de SG. Les derniers progrès enregistrés sont attribuables aux anticorps monoclonaux (AcM) ciblant les voies moléculaires qui régissent spécifiquement la prolifération et l’angiogenèse tumorales. Les chimiothérapies de première intention de référence – FOLFOX, FOLFIRI et XELOX – sont les schémas auxquels on ajoute les thérapies ciblées à l’essai.
Pertinence des thérapies ciblées
Lors de l’un des premiers essais de phase III où le bévacizumab, AcM humanisé ciblant le facteur de croissance de l’endothélium vasculaire (VEGF), a été ajouté à l’association irinotécan + 5-FU en bolus + leucovorine chez des patients dont le CCRm n’avait encore jamais été traité, la médiane de SG est passée de 15,6 à 20,3 mois (p<0,001) (Figure 1)2. Les premiers essais sur le cétuximab, AcM chimérique ciblant le récepteur du facteur de croissance épidermique (EGFR), ont en revanche été réalisés chez des patients dont le CCRm avait déjà été traité. Dans un essai sur le traitement de première intention, l’ajout du cétuximab au schéma de chimiothérapie FOLFIRI a donné lieu à une amélioration significative de la médiane de SG (23,5 vs 20,0 mois; taux de risque [HR] 0,796; p=0,0093), de la médiane de survie sans progression (SSP) (9,9 vs 8,4 mois; HR 0,696; p=0,0012) et du taux de réponse (57,3 % vs 39,7 %; risque relatif approché [OR], 2,069; p<0,001) comparativement au schéma FOLFIRI seul, mais ce bénéfice a été observé uniquement chez les porteurs du gène K-RAS de type sauvage3. Aucun bénéfice n’a été associé au traitement chez les patients dont le gène K-RAS avait muté, ce qui représente environ 40 % de tous les patients atteints d’un CCRm4.
Dans le traitement de deuxième intention et les traitements subséquents, le bévacizumab et les inhibiteurs de l’EGFR, le cétuximab et le panitumumab en l’occurrence, se sont tous révélés actifs dans diverses stratégies, voire en monothérapie dans certains cas. Lors d’un essai sur le traitement de deuxième intention réalisé chez des patients ayant déjà reçu une fluoropyrimidine et de l’irinotécan, l’ajout du bévacizumab au schéma FOLFOX a porté la médiane de SG de 10,8 à 12,9 mois (p=0,0011) par comparaison au schéma FOLFOX seul5. Dans le cadre de l’essai NCIC.CO17, le cétuximab en monothérapie a permis d’augmenter la médiane de SG de 4,6 à 6,1 mois (p=0,005) par rapport aux soins de soutien chez des patients qui avaient déjà reçu une fluoropyrimidine, de l’irinotécan et de l’oxaliplatine6. L’analyse du sous-groupe de patients porteurs du gène K-RAS de type sauvage a toutefois révélé que la médiane de SG était passée de 4,8 à 9,5 mois (p<0,001)7. Le panitumumab a pour sa part été étudié en monothérapie au sein d’une population similaire de patients dont le cancer avait progressé alors qu’ils recevaient la chimiothérapie de référence. Bien que le gain de SG n’ait pas été statistiquement significatif dans cet essai croisé, l’augmentation de la SSP a atteint le seuil de significativité statistique (p<0,0001)8. Comme dans le cas du cétuximab, le bénéfice associé au panitumumab se limitait aux patients porteurs du gène K-RAS sauvage9.
Figure 1. Traitement de première intention dans le CCRm jamais traité
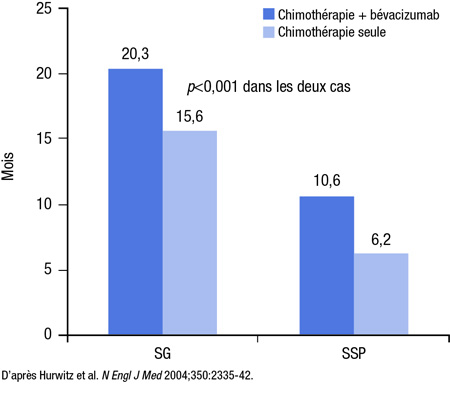
À la lumière de ces résultats, les guides de pratique préconisent maintenant l’ajout d’AcM au traitement de première et de deuxième intention10. Il importe ici de souligner que les paramètres traditionnels ne témoignent peut-être pas de la pleine valeur de ces thérapies ciblées, qui suppriment la croissance tumorale par opposition à tuer les cellules tumorales. Du fait qu’elles prolongent la survie tout en maintenant une qualité de vie acceptable, ces thérapies ciblées ouvrent la voie à une stratégie de prise en charge chronique au long cours, même en l’absence de guérison. Les résultats des essais divulgués au cours de la dernière année étayent d’ailleurs la pertinence d’une démarche thérapeutique chronique.
Traitement d’entretien après la première progression
Les données nouvellement publiées de l’essai de phase III ML18147 avec randomisation sur le bévacizumab témoignent des plus récents efforts que l’on déploie pour maîtriser la maladie à long terme en poursuivant ce traitement anti-VEGF9. Dans le cadre de cet essai ouvert, des patients dont le CCR avait progressé malgré l’ajout du bévacizumab à une chimiothérapie de première intention ont été randomisés de façon à recevoir une chimiothérapie de deuxième intention avec ou sans poursuite du traitement par le bévacizumab.
L’essai ML18147 regroupait 820 patients répartis dans 220 centres de recherche. Les critères d’admissibilité étaient les suivants : CCRm non résécable; traitement de première intention standard, c’est-à-dire une fluoropyrimidine en plus de l’oxaliplatine ou de l’irinotécan; et progression du cancer dans un délai de 3 mois après l’arrêt du schéma de première intention. Les patients dont le cancer avait progressé tôt, c’est-à-dire moins de 3 mois après le début du traitement de première intention, ont été exclus. Le choix de la chimiothérapie de deuxième intention dépendait du schéma de première intention : les patients ayant reçu de l’oxaliplatine en première intention recevaient de l’irinotécan en deuxième intention et vice versa.
À en juger par la médiane de SG, le paramètre principal, l’avantage associé à l’inhibition du VEGF était hautement significatif, le taux de risque (HR) ayant atteint 0,81 (IC à 95 % : 0,69-0,94; p=0,0062). En termes absolus, l’ajout du bévacizumab a permis de faire passer de 9,8 à 11,2 mois la médiane de SG à partir du début du traitement de deuxième intention (Figure 2). La médiane de SSP était de 5,7 mois chez les patients randomisés de façon à recevoir du bévacizumab vs 4,1 mois chez les patients randomisés de façon à recevoir la chimiothérapie seule (HR 0,68; p<0,0001). Quel qu’ait été le schéma de chimiothérapie, l’avantage associé au bévacizumab était très constant dans les analyses de sous-groupe prévues au protocole (indice fonctionnel ECOG, âge et nombre d’organes envahis par des métastases).
Figure 2. Essai ML18147 : bévacizumab en deuxième intention
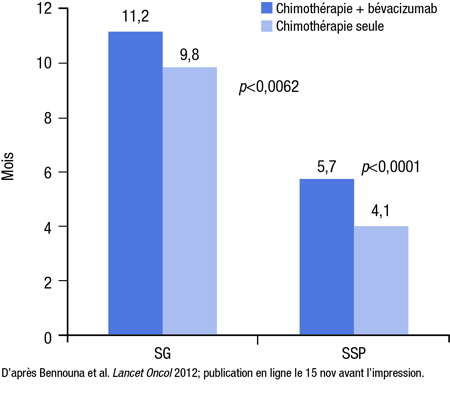
Le type et la sévérité des effets indésirables étaient similaires dans les deux groupes. Bien que la proportion absolue de patients ayant eu des effets indésirables de grade ≥3 ait été plus élevée sous bévacizumab (64 % vs 57 %), l’écart entre les groupes, peu importe l’effet indésirable considéré, était peu marqué. Par exemple, les deux effets indésirables de grade ≥3 les plus fréquents, la neutropénie (16 % vs 13 %) et la diarrhée (10 % vs 8 %), étaient légèrement plus fréquents sous bévacizumab, mais aucun autre effet indésirable de grade ≥3 n’a été observé chez >6 % des patients de l’un ou l’autre groupe. Parmi les sept décès considérés comme étant liés au traitement, quatre sont survenus dans le groupe bévacizumab et trois dans le groupe chimiothérapie seule.
Ces résultats confirment les données tirées d’études d’observation antérieures, telle l’étude BRiTE11, qui ont confirmé le bénéfice associé au traitement d’entretien par le bévacizumab chez des patients recevant plus d’un traitement. Si les schémas cytotoxiques sont souvent associés à une réponse moindre après un premier traitement, l’apparition d’une résistance au traitement par un inhibiteur du VEGF est moins probable, comme le montrent les résultats de l’essai ML18147.
Les résultats non publiés de l’essai BEBYP présentés en séance de dernière heure au plus récent congrès de l’ESMO (European Society for Medical Oncology) ont donné du poids au traitement d’entretien par un inhibiteur du VEGF12. Réalisé par le Gruppo Oncologico Nord Ovest (GONO), l’essai était conçu selon un plan semblable à celui du ML18147 et a été arrêté prématurément à la publication des résultats de l’essai ML18147.
Au moment où l’on a mis fin à l’essai, 185 patients atteints d’un CCRm qui avaient reçu du bévacizumab en sus de leur chimiothérapie de première intention ont été randomisés de façon à recevoir une chimiothérapie de deuxième intention avec ou sans bévacizumab. En raison de l’arrêt prématuré, le suivi a été trop bref pour faire ressortir un gain de SG, mais l’avantage au chapitre de la SSP a atteint le seuil de significativité statistique (HR 0,65; IC à 95 %;0,48-0,89; p=0,0062). En termes absolus, la médiane de SSP est passée de 4,97 à 6,77 mois. Là encore, le bénéfice était similaire selon toutes les analyses de sous-groupe prévues au protocole.
Maîtrise chronique du CCRm : le schème de références en métamorphose
Cliniquement pertinents, les résultats de ces études récentes ont d’importantes retombées sur le traitement du CCRm parce qu’ils génèrent encore plus d’intérêt pour la possibilité d’une maîtrise durable des cancers non résécables lorsque la guérison est improbable. Le bénéfice associé à l’inhibition durable du VEGF dans les traitements de première et de deuxième intention pourrait s’appliquer à d’autres traitements ciblant le VEGF, comme l’aflibercept, qui bloque la fixation à la fois du VEGF-A et du VEGF-B de même que du facteur de croissance placentaire13, ou à d’autres voies moléculaires, comme l’EGFR ou les enzymes qui régissent les cascades de signalisation intracellulaire de la prolifération.
Avec l’arrivée de nouveaux agents, il devient plus facile de prescrire un ou plusieurs inhibiteurs des voies moléculaires en association avec une chimiothérapie standard avant de passer à une autre stratégie. La FDA a récemment homologué l’aflibercept sur la foi des résultats de l’essai de phase III VELOUR, qui ont associé ce traitement à une augmentation moyenne de 1,4 mois de la SG lorsque ce dernier était prescrit en concomitance avec le schéma FOLFIRI en deuxième intention chez des patients qui avaient déjà reçu le schéma FOLFOX14. Parmi les 1226 patients randomisés, 373 (30 %) avaient déjà été exposés au bévacizumab. Les gains de SG et de SSP étaient similaires, que le bévacizumab ait déjà été utilisé ou non15.
Le regorafenib, que la FDA a aussi homologué récemment, est le premier inhibiteur multikinase micromoléculaire pour la voie orale à être commercialisé pour le traitement du CCRm. Agissant sur les tyrosine kinases qui participent à la cascade de signalisation du VEGF et de l’EGFR, le regorafenib s’est révélé bénéfique lors d’une étude de phase III regroupant des patients dont le CCRm avait progressé après des traitements standard, dont le 5-FU, l’irinotécan, l’oxaliplatine, le bévacizumab, le cétuximab et le panitumumab (Figure 3)16. Au sein de cette population, le regorafenib oral a fait passer la médiane de SG de 5,0 mois chez les patients recevant uniquement des soins de soutien à 6,4 mois (HR 0,77; IC à 95 % : 0,64-0,94; p=0,0052). L’effet de grade ≥3 le plus fréquent était le syndrome cutané mains-pieds (17 %), et aucun autre effet de grade ≥3 n’est survenu chez plus de 10 % des patients.
Figure 3. CORRECT : Analyse de la survie globale par sous-groupe
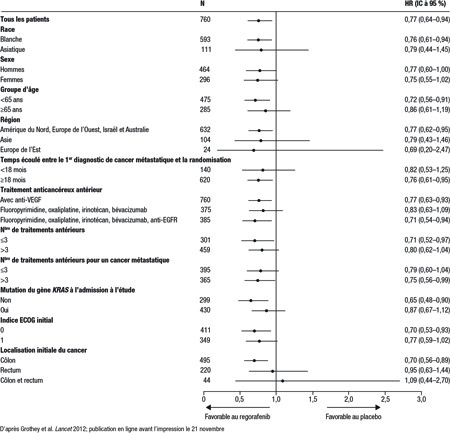
La tolérabilité de ces thérapies ciblées contribue largement au principe voulant que le CCRm puisse de plus en plus être traité comme une maladie chronique, l’objectif ultime étant une prolongation de la survie et le maintien de la qualité de vie. Certes, la guérison demeure hors de portée pour la majorité des patients atteints d’un CCRm, mais ces progrès récents sont des pas importants vers l’amélioration quantitative et qualitative de la survie.
Conclusion
Du fait qu’il a associé le bévacizumab à un bénéfice durable dans le traitement de première et de deuxième intention, l’essai de phase III ML 18147 pourrait redéfinir la prise en charge du CCRm non résécable. Il a également renforcé les données montrant que le blocage continu des mécanismes moléculaires régissant la prolifération et l’angiogenèse tumorales peut prolonger la survie. L’homologation de l’aflibercept et du regorafenib sur la foi de leur activité favorable dans le CCRm avancé augmentera la possibilité de gains de survie supplémentaires à mesure que se préciseront les stratégies optimales d’utilisation des thérapies ciblées.
Références
1. Scheithauer et al. Randomised comparison of combination chemotherapy plus supportive care with supportive care alone in patients with metastatic colorectal cancer. BMJ 1993;
306(6880):752-5.
2. Hurwitz et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004;350(23):2335-42.
3. Van Cutsem et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 2009;360(14):1408-17.
4. Van Cutsem et al. Cetuximab plus irinotecan, fluorouracil, and leucovorin as first-line treatment for metastatic colorectal cancer: updated analysis of overall survival according to tumor KRAS and BRAF mutation status. J Clin Oncol 2011;29(15):2011-19.
5. Giantonio et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007;25(12):1539-44.
6. Jonker et al. Cetuximab for the treatment of colorectal cancer. N Engl J Med 2007;357(20):2040-8.
7. Karapetis et al. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med 2008;359(17):1757-65.
8. Van Cutsem et al. Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 2007;25(13):1658-64.
9. Amado et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008;26(10):1626-34.
10. Edwards et al. A systematic review of treatment guidelines for metastatic colorectal cancer. Colorectal Dis 2012;14(2):e31-e47.
11. Grothey et al. Bevacizumab beyond first progression is associated with prolonged overall survival in metastatic colorectal cancer: results from a large observational cohort study (BRiTE). J Clin Oncol 2008;26(33):5326-34.
12. Masi et al. A randomized phase III study evaluating the continuation of bevacizumab (BV) beyond progression in metastatic colorectal cancer patients who received BV as part of first-line treatment: results of the BEBYP trial, par le Gruppo Oncologico Nord Ovest (GONO). European Society for Medical Oncology (ESMO) 2012; Vienne, Autriche. Résumé LBA17.
13. Mitchell EP. Targeted Therapy for Metastatic Colorectal Cancer: Role of Aflibercept. Clin Colorectal Cancer 2012;publication en ligne le
24 octobre avant impression.
14. Joulain et al. Aflibercept versus placebo in combination with FOLFIRI in previously treated metastatic colorectal cancer: mean overall survival estimation from a phase III trial (VELOUR). American Society of Clinical Oncology (ASCO) 2012; Chicago. Résumé 3602.
15. Allegra et al. Effects of prior bevacizumab use on outcomes from the VELOUR study: a phase III study of aflibercept and FOLFIRI in patients with metastatic colorectal cancer after failure of an oxaliplatin regimen. In : American Society of Clinical Oncology (ASCO) 2012; Chicago. Résumé 3605.
16. Grothey et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2012;publication en ligne le 22 novembre avant impression.