Comptes rendus
William Osler Health System
Le présent compte rendu est fondé sur des données médicales présentées lors d'un congrès de médecine reconnu ou publiées dans une revue avec comité de lecture ou dans un commentaire signé par un professionnel de la santé reconnu. La matière abordée dans ce compte rendu s'adresse uniquement aux professionnels de la santé reconnus du Canada.
PERSPECTIVE PROFESSIONNELLE - L’heure est au PROTOCOLE - Point de vue régional sur les preuves et les changements qui en découlent
mai 2013
Sous la direction de :
Dominic L. Raco, MD, FRCPC, FACC
Directeur général de la cardiologie et
Directeur médical du système de santé cardiovasculaire
William Osler Health System
Brampton et Etobicoke (Ontario)
Introduction
Le William Osler Health System a récemment modifié son algorithme de traitement antiplaquettaire dans la prise en charge des syndromes coronariens aigus (SCA). La modification – dont l’objectif est de réduire significativement le risque d’événement cardiovasculaire (CV) majeur – consiste à remplacer le traitement de référence antérieur, l’association clopidogrel + AAS, par l’un des nouveaux antiplaquettaires en association avec l’AAS. Dans le nouvel algorithme, on précise dans quels cas le prasugrel et le ticagrelor doivent être utilisés pour conférer une protection supplémentaire contre les événements CV majeurs. À en juger par les résultats des essais cliniques d’envergure qui ont motivé la mise à jour de l’algorithme, les recommandations ouvrent la porte à des gains cliniques découlant d’un effet antiplaquettaire plus marqué et, dans certains cas, d’un risque moindre de décès. Ces avantages s’accompagnent d’un risque faible ou acceptable d’hémorragie majeure ou mineure. Compte tenu de l’importance fondamentale de désactiver les plaquettes pour modifier l’évolution naturelle d’un SCA, il est essentiel d’optimiser le traitement antiplaquettaire pour améliorer le pronostic des SCA. Précisons enfin que le nouveau protocole est compatible avec la mise à jour des recommandations nationales.
Traitement de référence antérieur :
une amélioration s’imposait
Pendant plus de 10 ans, la bithérapie antiplaquettaire clopidogrel + AAS a été la norme dans la prise en charge des SCA, mais le taux d’événements CV chez les patients ayant subi un SCA demeurait assez élevé. Lors de l’essai phare CURE, 10 % des sujets recevant la bithérapie clopidogrel + AAS ont été victimes d’un infarctus du myocarde (IM) récidivant, d’une occlusion artérielle persistante ou d’un décès d’origine CV bien que le recours à la bithérapie ait permis de diminuer de 20 % le risque de survenue de ces événements par rapport à l’AAS seul1. Cette étude a été réalisée chez des patients atteints d’angor instable (AI) ou ayant subi un IM sans sus-décalage du segment ST (NSTEMI). Lors de l’essai CLARITY-TIMI 28, qui ciblait plutôt des patients ayant subi un IM avec sus-décalage du segment ST (STEMI), le risque résiduel de décès, d’AVC ou d’IM s’élevait à 9 % dans le groupe clopidogrel + AAS malgré une diminution de 31 % du risque d’événement CV majeur par rapport à l’AAS seul2.
Depuis le jour où ces études ont fait de la bithérapie clopidogrel + AAS le traitement de référence des SCA, deux essais d’envergure sur les SCA ont prouvé qu’un traitement antiplaquettaire plus efficace pouvait réduire davantage le risque CV. Dans l’un de ces essais, le ticagrelor était administré à tous les patients en proie à un SCA qui se présentaient à l’hôpital3. Dans l’autre essai, le prasugrel était administré à des patients en proie à un SCA qui étaient censés subir une intervention coronarienne percutanée (ICP)4. Les données de ces essais nous permettent d’envisager de meilleurs résultats qu’avec le traitement de référence antérieur clopidogrel + AAS.
Dans le cadre de l’essai TRITON TIMI-38, 13 608 patients en proie à un SCA qui devaient subir une ICP ont été randomisés. Au sein de la cohorte AI/NSTEMI, le clopidogrel ou le prasugrel n’étaient pas administrés tant que l’anatomie des coronaires n’avait pas été explorée par angiographie. Les sujets de la cohorte STEMI étaient autorisés à recevoir du clopidogrel ou du prasugrel avant l’ICP, mais 72 % de ces patients n’ont pas reçu le médicament à l’étude tant que l’anatomie des coronaires n’a pas été confirmée. Les patients du groupe expérimental recevaient une dose d’attaque de prasugrel (60 mg) suivie d’une dose d’entretien de prasugrel (10 mg/jour), alors que le groupe de comparaison recevait une dose d’attaque de clopidogrel (300 mg) suivie d’une dose d’entretien de clopidogrel (75 mg/jour). Les deux groupes recevaient de l’AAS. Environ 25 % des SCA étaient des STEMI; les autres étaient des épisodes d’AI et des NSTEMI.
Par comparaison au clopidogrel, le prasugrel a diminué de 19 % le risque de survenue d’un événement compris dans le paramètre mixte (mort imputable à un événement CV, IM ou AVC) (HR 0,81; p<0,001). Sous prasugrel, le risque d’hémorragie majeure a augmenté de 32 % (HR 1,32; p=0,03) par rapport au clopidogrel, mais il n’y avait aucune différence sur le plan de la mortalité. Les auteurs ont conclu qu’il fallait soupeser la protection accrue contre les récidives ischémiques en regard du risque hémorragique accru. Des analyses post hoc ont toutefois permis d’orienter la sélection des candidats.
Dans l’essai PLATO, tous les sujets admis à l’hôpital pour un SCA ont été randomisés sans égard à l’intervention qu’ils allaient subir ou au traitement antiplaquettaire qu’ils avaient reçu antérieurement. Le groupe expérimental recevait une dose d’attaque de ticagrelor (180 mg), puis une dose d’entretien de ticagrelor (90 mg 2 fois/jour), tandis que le groupe de comparaison recevait une dose d’attaque de clopidogrel (300 ou 600 mg), puis une dose d’entretien de clopidogrel (75 mg/jour). Les deux groupes recevaient de l’AAS. Environ 37 % des 18 624 patients randomisés avaient eu un STEMI et les autres, un NSTEMI.
Par rapport au clopidogrel, le ticagrelor a diminué de 16 % le risque de survenue d’un événement compris dans le paramètre mixte (décès d’origine vasculaire, IM ou AVC) (HR 0,84; p<0,001). Sur le plan des hémorragies majeures totales, l’écart entre les deux groupes n’a pas atteint le seuil de significativité statistique (11,6 % vs 11,2 %; p=0,43. Fait unique dans un essai sur des antiplaquettaires, le ticagrelor a été associé à une diminution de 16 % (HR 0,84; valeur nominale de p<0,001) de la mortalité toutes causes confondues.
Mise en application des nouvelles données
Le but des modifications apportées aux protocoles de traitement antiplaquettaire pour les patients en proie à un SCA était de nous permettre d’améliorer nos résultats à la lumière des résultats des essais PLATO et TRITON-TIMI 38. Devant un SCA, la conduite standard à tenir consiste notamment en l’administration d’une bithérapie antiplaquettaire tôt après l’arrivée du patient au service des urgences. Le «protocole TRITON-TIMI 38» est dès lors difficile à appliquer, car il exige que la plupart de ces patients subissent d’abord une coronarographie; or, il arrive qu’elle n’ait pas lieu avant 24 à 48 heures. Plusieurs organismes d’envergure ont actualisé leurs recommandations de traitement antiplaquettaire en cas de SCA à la lumière des résultats des essais PLATO et TRITON-TIMI 38, mais les régions et les établissements doivent les adapter en fonction de leurs ressources et des normes de pratique locales afin que leur mise en application soit efficace, sûre et efficiente.
Dans les établissements de la région, y compris le William Osler Health System, les résultats des essais PLATO et TRITON-TIMI 38 peuvent être appliqués directement. Tant dans les NSTEMI que dans les STEMI, le ticagrelor est devenu le partenaire habituel de l’AAS dans le cadre d’une bithérapie antiplaquettaire, mais il y a d’importantes exceptions. Au nombre des exceptions relatives figurent notamment les patients déjà sous anticoagulant ou ayant des antécédents d’hémorragie intracrânienne (Figure 1). On évite aussi le ticagrelor en présence d’un dysfonctionnement avancé du nœud sinusal ou du système de conduction. Dans les cas où le ticagrelor ne convient pas, le clopidogrel demeure le partenaire idéal de l’AAS. Chez les patients qui reçoivent déjà du clopidogrel mais chez qui le ticagrelor serait approprié selon l’algorithme, le traitement doit être changé.
Figure 1. William Osler Health System : Algorithme simplifié de la prise en charge d’un SCA
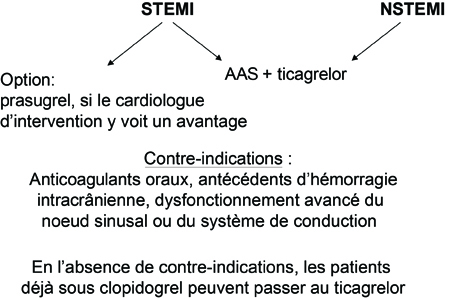
Même si le protocole de l’essai TRITON-TIMI 38 autorisait l’administration de prasugrel ou de clopidogrel avant l’angiographie, 72 % des patients qui avaient eu un STEMI n’ont reçu l’antiplaquettaire à l’étude qu’au moment de l’ICP. Par le passé, notre protocole prévoyait l’administration d’une bithérapie antiplaquettaire dès l’arrivée du patient au service des urgences ou, dans le cas d’un patient ayant eu un STEMI qui ne passait pas par les urgences, dès son arrivée en salle d’angiographie. En outre, comme le prasugrel a été associé à un risque hémorragique élevé dans certains groupes de patients (patients de >75 ans, patients de <60 kg et patients ayant des antécédents d’ischémie cérébrale transitoire ou d’AVC), il n’est pas indiqué en pareils cas. La simplicité est une condition sine qua non de la mise en application réussie de tout algorithme; on doit donc, dans la mesure du possible, éviter les multiples exceptions liées aux particularités d’un patient. Afin que notre protocole puisse s’appliquer au plus grand nombre possible de patients sans pour autant compromettre l’issue clinique, nous considérons aussi le ticagrelor comme un agent de choix chez les patients en proie à un STEMI. Le cardiologue d’intervention peut choisir le prasugrel en salle d’angiographie s’il estime que le prasugrel a plus de chances d’être avantageux que le ticagrelor ou le clopidogrel.
Il est peu probable que le prasugrel et le ticagrelor fassent un jour l’objet d’une comparaison directe. De plus, comme les méthodes utilisées dans leurs essais pivots respectifs étaient fort différentes, il est difficile de tirer des conclusions quant aux avantages éventuels de l’un par rapport à l’autre. Étant donné que nous avions déjà l’habitude d’administrer une bithérapie antiplaquettaire aux patients en proie à un SCA peu de temps après leur arrivée au service des urgences – exactement comme on l’a fait dans l’essai PLATO –, nous avons décidé de privilégier le ticagrelor à titre d’antiplaquettaire. Nous devrions ainsi observer chez nos patients une incidence moindre d’IM récidivants et d’AVC et une diminution absolue de 1,4 % de la mortalité totale, comme ce fut le cas lors de l’essai PLATO.
Pertinence du nouvel algorithme
dans les centres régionaux
À en juger par les données objectives voulant que les nouveaux antiplaquettaires puissent améliorer les résultats du traitement d’un SCA, la prise en charge devrait être adaptée, mais cette adaptation n’est pas obligatoire. Compte tenu des disparités importantes d’une région à l’autre dans la prise en charge d’un SCA, principalement imputables à la variabilité des ressources – comme la proximité des équipes d’intervention rapide et le délai d’entrée en salle de cathétérisme –, on doit adapter les recommandations thérapeutiques aux réalités régionales. Les centres régionaux doivent tenir compte de ces variables dans leur algorithme, mais ils ne doivent pas pour autant rater des occasions d’utiliser des schémas antiplaquettaires plus efficaces. Les habitudes de pratique dans les centres régionaux devraient s’appliquer aux hôpitaux communautaires, que le transfert des patients soit monnaie courante ou non.
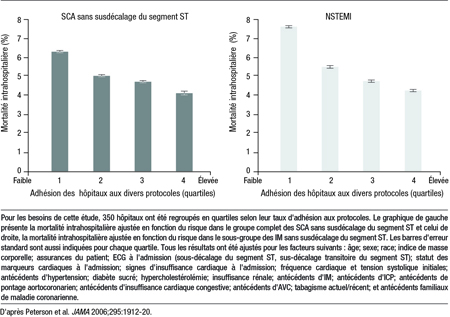
De solides données nous permettent de conclure que le recours à des stratégies plus modernes chez les sujets appropriés améliore l’issue clinique des SCA et peut même diminuer la mortalité. Dans la prise en charge des SCA, la mise en application de recommandations thérapeutiques a été associée à une amélioration statistiquement significative des résultats. Dans le cadre d’une étude d’observation qui regroupait 350 centres universitaires et non universitaires, à chaque augmentation de 10 % de l’adhésion aux recommandations factuelles correspondait une diminution de 10 % de la mortalité intrahospitalière (Figure 2)5.
Figure 2. Association entre le taux d’adhésion des hôpitaux aux protocoles et la mortalité intrahospitalière
Conclusion
Les stratégies antiplaquettaires de première intention dans la prise en charge des SCA ont été révisées. Le ticagrelor et le prasugrel, deux nouveaux agents, nous donnent une bonne occasion d’améliorer les résultats par rapport au clopidogrel lorsqu’ils sont associés à l’AAS. Chez les patients en proie à un épisode d’AI/NSTEMI ou à un STEMI, pour autant qu’ils aient été bien sélectionnés, le ticagrelor est plus avantageux que le clopidogrel et peut même réduire la mortalité. Le William Osler Health System a formulé ses recommandations expressément pour permettre à ses médecins de repérer ces occasions dans un algorithme facile à appliquer.
Questions et réponses
Q : Que pensez-vous du ratio bénéfice:risque des nouveaux antiplaquettaires dans le contexte de l’algorithme que l’on a actualisé pour diminuer le risque de thrombose tout en maintenant un taux acceptable d’hémorragies?
R : Dans notre analyse du rapport coût-avantage, le patient passe toujours en premier. L’aspect économique est secondaire à nos yeux. Lors de PLATO et de TRITON-TIMI 38, le ticagrelor et le prasugrel se sont révélés nettement supérieurs au clopidogrel. La diminution de la mortalité observée dans PLATO est un résultat fort important auquel se greffe un faible risque d’hémorragie mortelle. Le patient doit recevoir le médicament le plus efficace et le plus sûr malgré son coût.
Q : Les essais qui ont motivé l’actualisation des recommandations comparaient des antiplaquettaires dans différents sous-groupes de patients. Pourquoi, à votre avis, était-il important de prouver la supériorité du prasugrel ou du ticagrelor sur le clopidogrel dans différents types de SCA (STEMI, NSTEMI, AI, etc.)?
R : De notre point de vue à nous, il est plus facile de mettre en pratique les résultats de PLATO que ceux de TRITON-TIMI 38, car PLATO regroupait des patients en proie à un épisode d’AI, à un NSTEMI ou à un STEMI qui se présentaient aux urgences. Or, c’est précisément là que sont traités la majorité des patients de nos établissements. Dans TRITON-TIMI 38, les patients attendaient 1 ou 2 jours avant l’angiographie et l’instauration subséquente de la bithérapie antiplaquettaire.
Q : Que pensez-vous des éventuels effets indésirables des nouveaux antiplaquettaires compte tenu des meilleurs résultats qu’ils permettent d’obtenir?
R : L’augmentation du risque hémorragique est toujours un facteur à considérer, mais dans PLATO, il n’y avait pas de différence entre les groupes quant aux hémorragies mortelles; de plus, le ticagrelor est un antiplaquettaire réversible. La diminution initiale de la mortalité observée dans PLATO est rassurante, et l’incidence moindre d’IM récidivants est de bon augure également, puisque la préservation du muscle cardiaque a des retombées sur l’issue clinique à long terme. Nous savons d’expérience que la sensation d’essoufflement peut persister pendant plusieurs semaines, alors nous rassurons les patients en leur disant qu’elle disparaîtra. Il semble que l’oxyde nitrique (NO) soit en cause. En effet, selon une hypothèse, la dyspnée tiendrait au fait que le ticagrelor favorise l’augmentation des taux d’adénosine, ce qui augmente la synthèse de NO vasculaire. La synthèse accrue de NO pourrait expliquer en partie la diminution de la mortalité associée au ticagrelor – comparativement au clopidogrel – au-delà la période critique d’un SCA6.
Q : L’algorithme comporte des points de décision qui n’y étaient pas lorsque tous les patients recevaient du clopidogrel et de l’AAS. Que doit-on faire pour améliorer les résultats?
R : Pour éviter les erreurs, nous avons réduit au minimum les points de décision. Par souci de simplicité et d’efficacité et pour ne pas compromettre la qualité des soins prodigués aux patients, nous optons pour l’association ticagrelor + AAS comme traitement de référence, à moins qu’elle ne soit contre-indiquée. Si, par exemple, le patient a des antécédents d’hémorragie intracrânienne, il va de soi qu’une discussion avec le cardiologue d’intervention s’impose.
Références
1. Yusuf et al. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation.
N Engl J Med 2001;345(7):494-502.
2. Sabatine et al. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with STsegment elevation. N Engl J Med 2005;352(12):1179-89.
3. Wallentin et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009;361(11):1045-57.
4. Wiviott et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007;357(20):2001-15.
5. Peterson et al. Association between hospital process performance and outcomes among patients with acute coronary syndromes. JAMA 2006;295(16):1912-20.
6. Serebruany VL. Adenosine release: A potential explanation for the benefit of ticagrelor in the PLATelet Inhibition and Clinical Outcomes trial? Am Heart J 2011;161:1-4.